
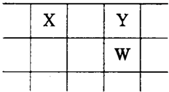
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法不正确的是( )| A、五种元素中,X最难形成离子化合物 |
| B、五种元素中,Q的最高价含氧酸的酸性强 |
| C、Y的简单阴离子比W的简单阴离子还原性强 |
| D、Z与Q形成的化合物水溶液一定显酸性 |


科目:高中化学 来源: 题型:
| A、元素非金属性Cl>S的实验依据是酸性HClO4>H2SO3 |
| B、碳元素的电负性小于氧元素,每个CO2分子中有4个σ键 |
| C、同周期主族元素的原子形成的简单离子的电子层结构一定相同 |
| D、Na、Mg、Al三种元素,其第一电离能由大到小的顺序为Mg>Al>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用太阳能制氢 |
| B、推广使用煤液化技术 |
| C、举行“地球一小时”熄灯活动 |
| D、关停小火电企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:
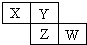 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、Y的氢化物沸点较高是因为其相对分子质量比较大 |
| B、W的最高价氧化物对应水化物的酸性比Z的强 |
| C、Z的非金属性比Y的强 |
| D、X与Y形成的化合物中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯中的甲苯(酸化高锰酸钾溶液 分液) |
| B、乙醇中的水(无水硫酸铜 干燥) |
| C、乙醇中的乙酸(NaOH溶液 分液) |
| D、苯中的溴:(NaOH溶液 分液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸热反应不加热就不会发生 |
| B、据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| C、化学反应除了生成新的物质外,还伴随着能量的变化 |
| D、放热的化学反应不需要加热就能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,15 g甲基(-CH3)所含的电子数为7NA |
| B、水的摩尔质量就是NA个水分子的质量之和 |
| C、含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| D、1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com