
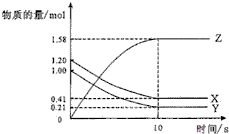
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )| A、达到平衡所需要的时间是10s |
| B、平衡时Y的转化率79.0% |
| C、该反应的化学方程式为X(g)+Y(g)?2Z(g) |
| D、前10s,用Z表示的反应速率为0.79mol/(L?s) |
| 1.0mol-0.21mol |
| 1.0mol |
| ||
| 10s |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 |
| B、“酸可以除锈”,“汽油可以去油污”都是发生了化学变化 |
| C、被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 |
| D、居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味的气体,它对人体极为有害,该气体是甲醛. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
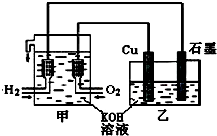 利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A、乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O |
| B、甲中通入氧气的电极为负极 |
| C、乙中阴离子向石墨电极移动 |
| D、电路上通过0.5mol电子,可制得0.5mol Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水显碱性:NH3?H2O═NH4++OH- |
| B、Na2S溶液显碱性:S2-+2H2O?H2S+2OH- |
| C、硫酸氢钠溶液显酸性:NaHSO4═Na++H++SO42- |
| D、AlCl3溶液显酸性:Al3++3H2O?Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有共价键的化合物不一定是共价化合物 |
| B、在共价化合物中一定含有共价键 |
| C、含有离子键的化合物一定是离子化合物 |
| D、离子键就是阴阳离子结合成化合物的静电引力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.01 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醇 | B、甲醛 | C、甲酸 | D、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com