
| A. | 2Na2O2+2N2O5═4NaNO3+O2↑ | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O4═2NaNO3 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2↑ |
分析 题给信息为:Na2O2可与某些元素的最高价氧化物反应,生成对应的盐(或碱)和O2,Na2O2具有强氧化性,与所含元素不是最高价态的氧化物反应时,只生成其最高价的盐,不生成O2.
解答 解:A.N2O5中N元素的化合价为+5价,是最高价态,与Na2O2反应时生成O2,反应的化学方程式为2Na2O2+2N2O5═4NaNO3+O2,故A正确;
B.NO2中N元素的化合价为+4价,不是最高价态,与Na2O2反应时不生成O2,反应的化学方程式为Na2O2+2NO2=2NaNO3,故B错误;
C.N2O3中N元素的化合价为+3价,不是最高价态,与Na2O2反应时不生成O2,Na2O2+N2O4═2NaNO34,故C正确;
D.Mn2O7中Mn元素的化合价为+7价,处于最高价态,与Na2O2反应时生成O2,故D正确;
故选B.
点评 本题考查化学反应规律的探究,题目难度中等,注意题中信息:Na2O2可与某些元素的最高价氧化物反应,生成对应的盐(或碱)和O2.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑤⑥⑦ | C. | ③④⑥⑦ | D. | ②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
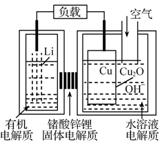 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )| A. | 电池放电时,正极附近溶液pH增大 | |
| B. | 工作时,Li+透过固体电解质向Cu极移动 | |
| C. | 电池放电过程中,空气中的O2并不参加反应 | |
| D. | 两极的有机电解质和水溶液电解质不可对换 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
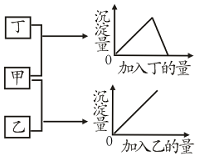 甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )
甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )| A. | Al2(SO4)3 | B. | NaOH | C. | FeSO4 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试验操作和现象 | 结论 |
| A | 向浓度均为0.1mol.L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 室温下,实验测得:0.1mol.L-1Na2CO3溶液的PH约为11.6;0.1mol.L-1NaHCO3溶液的PH约为7.9 | CO32-结合H+的能力比HCO3-的强 |
| D | 某盐酸溶液中滴加盐酸,产生无色无味气体,将气体通入澄清石灰水变浑浊 | 该盐一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
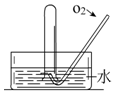 如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com