
下列关于化学键及晶体的说法中,不正确的是
A.Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大
B.NaOH和NH4Cl化学键类型相同
C.N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构
D.石英晶体是原子晶体,其分子式为SiO2
科目:高中化学 来源:2016-2017学年甘肃省高一上第一次月考化学试卷(解析版) 题型:计算题
常温下,将20.0g20.0%的NaCl溶液,跟10.0g35.0%的NaCl溶液混合,得到密度为1.17g/cm-3的混合溶液。计算 :
:
⑴该混合溶液中溶质的质量分数;
⑵该混合溶液溶质的物质的量浓度;
⑶在500g水中需溶入多少摩尔NaCl,才能使其浓度恰好与上述混合溶液的浓度相等?
(计算结果保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH- –14e-→2CO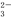 +12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
+12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶ 2
2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中,CO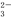 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:推断题
已知:① 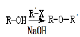 ②
②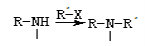
③C的化学式为C15H13NO4,—Bn含苯环但不含甲基。
盐酸卡布特罗是一种用于治疗支气管病的药物,其中间体的合成路线如下:
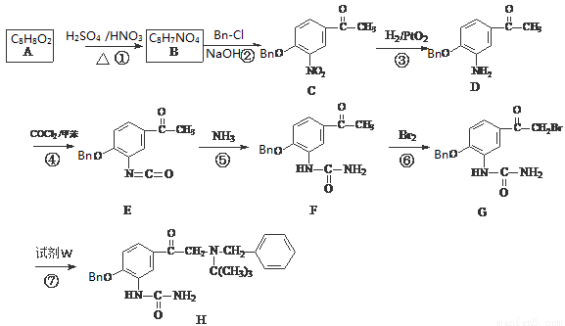
(1)写出结构简式:A W 。
(2)指出反应类型:反应① ,反应⑤ 。
(3)反应②的总化学方程式(-Bn用具体结构代入) 。
(4)写出所有同时符合下列条件的同分异构体:
①与A属于同系物 ②1H的核磁共振谱图只有4个峰 ③分子中碳原子数目等于10
(5)试利用上述合成路线的相关信息,由甲苯、(CH3)2NH等合成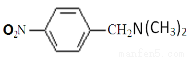 (无机试剂任用)
(无机试剂任用)
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
已知:SO32-+I2+H2O=SO42-+2I-+2H+,某无色溶液中可能含Na+、NH+ 4、Cu2+、K+、I-、SO32-,SO42-,且所有离子物质的量浓度相等。向溶液中滴加少量氯水,溶液呈无色(不考虑盐类的水解及水的电离)。下列关于该溶液的判断正确的是
A.肯定不含I- B.不能确定是否含有SO42-
C.至少含有Na+、NH+ 4、K+中的两种 D.可能含有Cu2+
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.裂化可以提高汽油等轻质油的产量和质量
B.硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油
C.乙醇、乙酸、乙酸乙酯分子中均存在-OH
D.向2 mL苯中加入1 mL碘的CCl4溶液,振荡后静置,上层呈紫红色
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
下列关于著名科学家及其成就的描述不正确的是
A.德国化学家维勒第一次人工合成了尿素,从而揭开了人工合成有机物的序幕
B.中国化学家侯德榜成功发明了侯氏制碱法,打破了外国当时对中国的相关技术封锁
C.英国科学家卢瑟福根据α粒子散射实验提出了“葡萄干面包式”原子结构模型
D.俄国化学家门捷列夫在前人基础上研究提出了元素周期律并列出了第一张元素周期表
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上第一次月考化学试卷(解析版) 题型:选择题
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g) COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上10月月考化学试卷(解析版) 题型:填空题
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g)ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g)ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_________________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡状态的标志__________。
A.消耗1 mol N2同时生成1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,右图变化趋势正确的是________(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数________。(填“变大”、“变小”或“不变”)
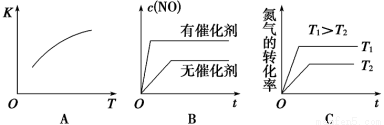
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_____________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com