
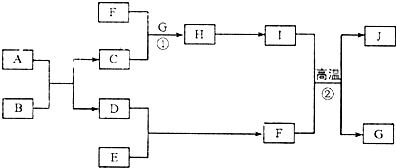
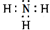 ,含有的化学键类型是极性共价键
,含有的化学键类型是极性共价键分析 E是空气中含量最多的单质,则E为N2,A是常见的金属单质,B是常见的强酸,生成的C、D为氯化物和氢气,D能与E反应生成F,则D为H2,所以F为NH3,I是既能与强酸又能与强碱反应的氧化物,则I为Al2O3,G是最常见的无色液体,则G为H2O,J是一种高硬度材料(摩尔质量为41g•mol-1),I和F反应生成G和J,根据元素守恒可知J为AlN,根据物质的转化关系可知H为,C为含铝离子的盐,则A为Al,依据推断回答问题.
解答 解:E是空气中含量最多的单质,则E为N2,A是常见的金属单质,B是常见的强酸,生成的C、D为氯化物和氢气,D能与E反应生成F,则D为H2,所以F为NH3,I是既能与强酸又能与强碱反应的氧化物,则I为Al2O3,G是最常见的无色液体,则G为H2O,J是一种高硬度材料(摩尔质量为41g•mol-1),I和F反应生成G和J,根据元素守恒可知J为AlN,根据物质的转化关系可知H为,C为含铝离子的盐,则A为Al,
(1)组成A的元素为铝元素,铝在周期表中的位置是第三周期第ⅢA族,
故答案为:第三周期第ⅢA族;
(2)F的电子式为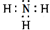 ,含有的化学键类型是极性共价键,
,含有的化学键类型是极性共价键,
故答案为: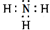 ;极性共价键;
;极性共价键;
(3)反应①的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3 NH4+;
(4)反应②的化学方程式为:Al2O3+2NH3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3H2O,
故答案为:Al2O3+2NH3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3H2O;
(5)A为Al,A与烧碱溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,若此反应中生成VL的氢气,即其物质的量为$\frac{V}{22.4}$mol,则转移电子的物质的量为2×$\frac{V}{22.4}$mol=$\frac{V}{11.2}$mol,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;$\frac{V}{11.2}$;
(6)B不可以是稀硝酸或浓硝酸,因为铝与稀硝酸反应不生成氢气,铝与浓硝酸会发生钝化,
故答案为:不同意,铝与稀硝酸反应不生成氢气,铝与浓硝酸会发生钝化.
点评 本题考查了物质转化关系分析判断,主要是铝及其化合物性质,氮及其化合物性质的分析应用,注意反应特征的理解应用是解题关键,题目难度中等.


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
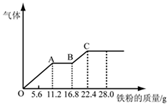 向稀硫酸和稀硝酸的混合溶液200mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体).下列分析错误的是( )
向稀硫酸和稀硝酸的混合溶液200mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体).下列分析错误的是( )| A. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2 | |
| B. | A点溶液中的溶质为Fe(NO3)3和H2SO4 | |
| C. | 原混合酸中NO3-物质的量为0.2mol | |
| D. | 原混合酸中H2SO4的物质的量浓度为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 20% | C. | 15% | D. | 10% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氧气中点燃 | |
| B. | 氮气与氢气在高温高压和有催化剂条件下反应 | |
| C. | 氢氧化钠溶液与盐酸混合 | |
| D. | 二氧化氮与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
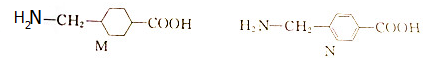
| A. | 1mol M完全燃烧生成6.5mol H2O | B. | CH3CH2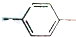 NO2与N互为同分异构体 NO2与N互为同分异构体 | ||
| C. | M、N分子中所有碳原子均共平面 | D. | M、N的核磁共振氢谱均只有5个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、HCO3-、SO42-、OH- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | Na+、H+、CO32-、Cl- | D. | Na+、Mg2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可作为袋装食品的干燥剂 | B. | 氨气是生产硝酸的主要原料 | ||
| C. | Fe3O4可用于制备红色油漆、涂料 | D. | NH4HCO3可用作化肥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com