
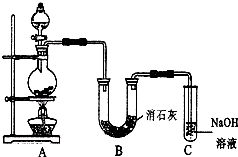
 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).分析 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,利用氯气与潮湿的消石灰反应制取少量漂白粉,剩余氯气被氢氧化钠溶液吸收,
(1)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气,依据化学方程式定量关系分析,每4molHCl反应,只有2molHCl被氧化;
(2)氯气与碱石灰反应生成氯化钙、次氯酸钙、水;
(3)氯气有毒不能排放在环境中;
(4)根据题意知,降低温度即可;氢氧化钙能和氯化氢反应生成氯化钙;
(5)酸性条件下生成HClO,漂白性增强.
解答 解:(1)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气,发生MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,每4molHCl反应,生成1molCl2,只有2molHCl被氧化,若在标准状态下收集到33.6L的氯气物质的量=$\frac{33.6L}{22.4L/mol}$=1.5mol,被氧化的HCl物质的量=3mol,
故答案为:3mol;
(2)因氯气与碱石灰反应生成氯化钙、次氯酸钙和水,化学反应方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(3)因氯气有毒,则装置C的作用为吸收未完全反应的氯气,防止污染空气,
故答案为:吸收未完全反应的氯气,防止污染空气;
(4)①因温度较高时发生副反应生成Ca(ClO3)2,则可将B装置冷却来避免该副反应的发生,
故答案为:将B装置冷却(或将B装置放在冷水浴中);
②因浓盐酸易挥发,则另一个副反应为HCl与碱石灰反应,反应为Ca(OH)2+2HCl═CaCl2+2H2O,所以应除去氯气中的HCl,即在A、B之间接一个饱和的NaCl溶液洗气瓶可除去HCl,
故答案为:Ca(OH)2+2HCl═CaCl2+2H2O;在A、B之间接一个饱和的NaCl溶液洗气瓶;
(5)酸性条件下生成HClO,漂白性增强,只有B符合,A为中性,C、D为碱性,
故答案为:B.
点评 本题考查氯气的化学性质、氯气的实验室制法、尾气的处理等知识点,注意把握习题中的信息分析(4),侧重分析与实验能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该电池的电解液可以选用KOH溶液,负极是Cd,正极是NiOOH | |
| B. | 该电池放电时,负极反应为:Cd-2e-+2OH-=Cd(OH)2 | |
| C. | 该电池充电过程中,阴极附近的溶液PH降低 | |
| D. | 该电池充电时,阳极反应为:2Ni(OH)2-2e-+2OH-=2NiOOH+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 使用分液漏斗和容量瓶时,首先要查漏 | |
| B. | 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体暴沸 | |
| C. | 向试管中加液体时,胶头滴管紧贴试管内壁 | |
| D. | 用蒸发皿进行加热蒸发时,一定要垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
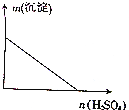 向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )| A. | 硝酸钙与硫酸钾的混合液 | B. | 氯化钡与碳酸钠的混合液 | ||
| C. | 硫酸镁与氢氧化钾的混合液 | D. | 氯化铝与硝酸钠的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 先通二氧化碳、后通氨气、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循环使用 | D. | 往甲中通CO2有利于制备(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com