
【题目】为测定X的成分,设计并完成如下实验:
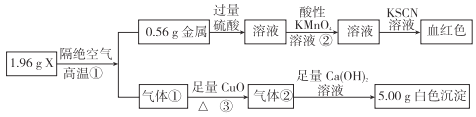
请回答:
(1)X的化学式是___________。
(2)反应②的离子方程式:___________。
(3)反应①的化学方程式:___________。
【答案】 Fe(CO)5 5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O Fe(CO)5![]() Fe+5CO↑
Fe+5CO↑
【解析】本题考查物质推断,根据流程图,加入KSCN溶液,溶液为血红色,说明X中含有铁元素,即铁元素的质量为0.56g,根据流程气体①能够还原CuO,且气体②能与足量Ca(OH)2溶液,产生白色沉淀,即沉淀为CaCO3,说明气体①为CO,CO的质量为(1.96-0.56) g=1.4g,物质的量之比为n(Fe):n(CO)=0.56/56:1.4/28=0.01:0.05=1:5,因此X为Fe(CO)5,(1)根据上述分析,X为Fe(CO)5:(2)反应②利用高锰酸钾的氧化性,把Fe2+氧化成Fe3+,MnO4-被还原成Mn2+,然后根据化合价的升降法进行配平,即5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O;(3)反应①的方程式为: Fe(CO)5![]() Fe+5CO↑。
Fe+5CO↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液与30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g/cm3的混合溶液.计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,相同体积的甲、乙两种气体的质量比是17∶14。若乙气体是CO,则甲气体可能是( )
A. H2S B. HCl C. NH3 D. Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A. SO2有漂白性,可广泛用于食品增白工业
B. 浓硫酸不能与Al反应,故可用铝槽车运送浓硫酸
C. 14C可用于文物年代鉴定,14C与12C互为同位素
D. 从海水中提取的所有物质都须通过化学反应才能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84 消毒液” 瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:

(1)该“84 消毒液” 的物质的量浓度约为________mol·L-1(计算结果保留 2 位有效数字)。
(2)某同学取 100 mL 该“84 消毒液” ,稀释后用于消毒,稀释后的溶液中 c(Na+)=____mol·L-1。
(3)该同学参阅该“84 消毒液” 的配方,欲用 NaClO 固体配制 480 mL 含 NaClO 质量分数为 25%的消毒液。下列说法正确的是______(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B. 将称量好的 NaClO 固体在烧杯中溶解后应立即转入容量瓶并加水至刻度线
C. 定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO 固体的质量为 143.0 g

(4)该同学对容量瓶及其使用方法的认识中正确的是(_______)
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后, 需要烘干后再使用
C. 配制溶液过程中,容量瓶内液体只需要一次摇匀过程
D.使用前要检查容量瓶是否漏水
(5) “84 消毒液” 与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为 1.84 g·cm-3)的浓硫酸配制 2 L 2.3 mol·L-1的稀硫酸用于增强“84 消毒液”的消毒能力。
①所配制的稀硫酸中, H+的物质的量浓度为_______mol·L-1。
②需用浓硫酸的体积为_______mL。
(6) “84 消毒液” 如果不慎与“洁厕灵” (主要成分是盐酸)会产生有毒气体氯气。请写出发生反应的离子方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 碳酸钡溶于醋酸:BaCO3+2H+===Ba2++H2O+CO2↑
C. 金属钠跟水反应:2Na+2H2O===2Na++2OH-+H2↑
D. 澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

(1)固体I中主要成分为__________,捕获剂所捕获的气体主要是_________。
(2)处理含NH4+废水时,发生反应的离子方程式为___________。
(3)若X为适量空气,严格控制空气用量的原因是____________。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________。
增加压强,NO的转化率__________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com