
下列叙述正确的是
①不同核素之间形成的共价键一定是极性键
②当一个碳原子连接四个不同的原子或原子团时,该碳原子叫手性碳原子
③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素
④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O,CO2这样的分子
⑤冰中存在极性共价键和氢键两种化学键的作用
⑥熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、电解质、盐
⑦氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3•H2O分子,根据氨水的性质可知NH3•H2O的结构式为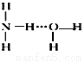
⑧σ键重叠方式为头碰头,成镜像对称;π键重叠方式为肩并肩,成轴对称
⑨干冰汽化破坏了共价键,氯化钠溶于水破坏了离子键
A. ②⑥ B.①②⑥ C. ②⑤⑥⑧ D. ③④⑥⑦⑨
 目标测试系列答案
目标测试系列答案科目:高中化学 来源:2015-2016学年福建省高一下期末化学试卷(解析版) 题型:选择题
在恒温恒容条件下,发生化学反应H2 (g)+I2 (g) 2HI (g),下列选项中不能作为达到平衡状态标志的是
2HI (g),下列选项中不能作为达到平衡状态标志的是
A.混合气体颜色不再变化
B.单位时间内生成nmol氢气的同时生成nmol碘蒸气
C.若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化
D.2v正(H2)=v逆(HI)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.100℃纯水的pH=6,说明加热可导致水呈酸性
B.pH=4的醋酸溶液,稀释至10倍后pH=5
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.25℃时,pH=3的醋酸溶液。与pH=11的NaOH溶液等体积混合后pH=7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是
A.Y和W的含氧酸均为强酸
B.YW3分子中Y原子的杂化方式为sp2,分子的空间构型为平面三角形
C.由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液
D.因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
长式周期表共有18个纵行,从左到右排为1﹣18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是
A. 第9列元素中没有非金属元素
B. 只有第二列的元素原子最外层电子排布为ns2
C. 第四周期第9列元素是铁元素
D. 第10、11列为ds区
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
下列有关叙述正确的是
A. 元素性质呈周期性变化的根本原因是元素化合价呈周期性变化
B. BF3和CO2分子中所有原子均满足最外层为8电子结构
C. 已知114号元素的一种核素的质量数为298,则该元素的相对原子质量为298
D. [14NH3T]+中,电子数、质子数、中子数之比为10:11:9
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一下期末化学试卷(解析版) 题型:简答题
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;
制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
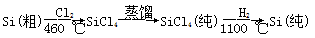
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
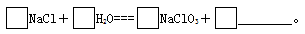
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:
(7)工业上,通过如下转化可制得KClO3晶体: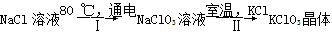
完成Ⅰ中反应的总化学方程式:
Ⅱ该反应过程能析出KClO3晶体而无其他晶体析出的原因是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:推断题
【加试题】某研究小组以烃A为主要原料,采用以下路线合成药物X和高聚物Y:
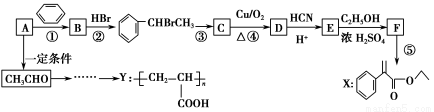
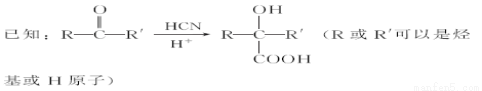
请回答下列问题:
(1)若反应①、②的原子利用率均为100%,则A的名称为________。
(2)反应③的条件是________________,反应⑤的反应类型是________________。
(3)写出反应④的化学方程式________________________________________。
(4)写出同时符合下列条件的E的所有同分异构体的结构简式:___________________。
ⅰ.属酚类化合物,且是苯的对位二取代物;ⅱ.能发生银镜反应和水解反应。
(5)以CH3CHO为原料可合成Y,请结合本题信息,设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图。CH3CH2OHH2C===CH2BrH2C—CH2Br
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:选择题
室温下,将1.000mol•L﹣1盐酸滴入20.00mL 1.000mol•L﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是:

A.a点由水电离出的c(H+)=1.0×10﹣14mol• L﹣1
L﹣1
B.b点 :c(NH4+)+c(NH3•H2O)=
:c(NH4+)+c(NH3•H2O)= c(Cl﹣)
c(Cl﹣)
C.c点:c(Cl﹣)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com