
| X | Y | Z | |
| 原子半径/nm | 0.154 | 0.130 | 0.071 |
| A. | 原子最外层电子数:Z>X>Y | B. | 三种元素可能为同周期元素 | ||
| C. | 原子序数:Y>X>Z | D. | 离子半径:X>Y>Z |
分析 X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,结合原子半径及X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构,则三种元素在周期表中相对位置为 ,结合元素周期律来解答.
,结合元素周期律来解答.
解答 解:X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,结合原子半径及X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构,则三种元素在周期表中相对位置为 ,
,
A.最外层电子数Z>Y>X,故A错误;
B.三种元素在周期表中相对位置为 ,因此三种元素不可能为同周期元素,故B错误;
,因此三种元素不可能为同周期元素,故B错误;
C.由位置可知,原子序数Y>X>Z,故C正确;
D.具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径Z>X>Y,故D错误;
故选C.
点评 本题考查位置、结构与性质的应用,为高频考点,把握离子具有相同电子层结构、元素的性质等推断元素的位置为解答的关键,侧重分析与推断能力的考查,注意周期律的应用,题目难度不大.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
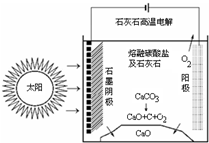 CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
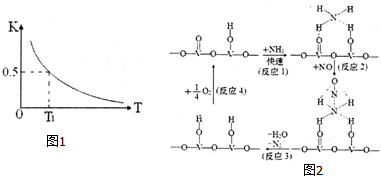 环境污染影响人类生存,治理污染是化学工作者研究的重要课题.
环境污染影响人类生存,治理污染是化学工作者研究的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 淀粉和纤维素都是高分子化合物,且都是非电解质 | |
| C. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-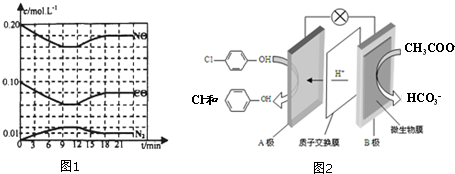
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com