
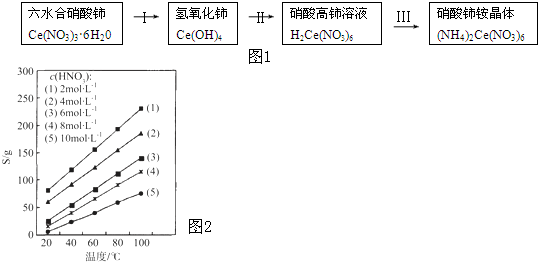
| ||
| ||
| ||
| Ksp |
| c(Ce着+) |
| 着 |
| ||


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:不详 题型:单选题
| A.能使湿润的淀粉KI试纸变蓝的物质一定是Cl2 |
| B.向某溶液中滴加硝酸酸化的Ba(NO3)2溶液后有白色沉淀生成,说明该溶液中一定含有SO42- |
| C.Zn粒分别放入稀HCl溶液和稀HNO3溶液中均有气泡产生,说明Zn与两种酸均发生置换反应 |
| D.向某溶液中加入氯水后,滴加KSCN溶液,溶液显红色,无法说明该溶液一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
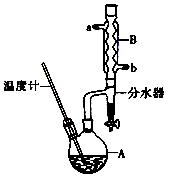
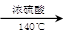 (CH3CH2CH2CH2)2O + H2O
(CH3CH2CH2CH2)2O + H2O | | 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解性 |
| 正丁醇 | 74 | 117.2 | 0.819 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
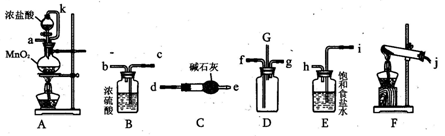
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
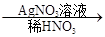 白色沉淀。请回答下列问题:
白色沉淀。请回答下列问题: 白色沉淀”有关反应的离子方程式____________________________。
白色沉淀”有关反应的离子方程式____________________________。| 实验步骤 | 预期现象和结论 |
| 取适量C的溶液于试管中, ① 。 | 预期现象和结论1: ② ; 预期现象和结论2: ③ ; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com