
| A、C(CH3)3CH2OH |
| B、CH(CH3)2CHOHCH3 |
| C、CH3CH2CHOHCH3 |
| D、CH3CH2CHOHCH2CH3 |


科目:高中化学 来源: 题型:
| A、熔点:F2<Cl2<Br2<I2 |
| B、微粒半径:F->Na+>Mg2+>Al3+ |
| C、酸性HClO4>H2SO4>H3PO4>H2SiO3 |
| D、热稳定性:HF<HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
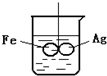 如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )| A、铁圈和银圈左右摇摆不定 |
| B、保持平衡状态 |
| C、铁圈向下倾斜,银圈向上倾斜 |
| D、银圈向下倾斜,铁圈向上倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有共价键的化合物必是共价化合物 |
| B、吸热反应在不加热的条件下一定不能发生 |
| C、放热反应在常温下一定很容易发生 |
| D、双原子单质分子中的共价健一定是非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铜和盐酸的反应:OH-+H+═H2O |
| B、氧化铜和盐酸的反应:Cu2++2H2O═2 H++Cu(OH)2↓ |
| C、铁与硫酸铜溶液的反应:Fe+Cu2+═Cu+Fe2+ |
| D、铁与稀硫酸的反应:Fe+2H+═Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
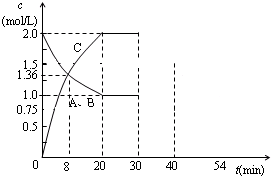 Ⅰ、某容积不变的密闭容器中充入等物质的量的气体A和B,某温度下发生反应:
Ⅰ、某容积不变的密闭容器中充入等物质的量的气体A和B,某温度下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com