
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.根据下列信息回答问题:
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.根据下列信息回答问题: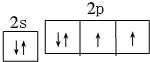
分析 (1)氧原子外围电子有6个电子,2s能级上有2个电子,2p能级上有4个电子,据此写出氧原子外围电子排布图;
(2)根据原子数目和价电子数目来分析等电子体;
(3)A、常温纯水pH=7,水电离时吸热过程,升温平衡正向进行,溶液pH减小;
B、水分子只含有H-O极性键,水分子为V型,构成极性分子;
C、水在化学反应中化合价可以升高也可以降低;
D、水分子中无双键;
(4)水中氧的杂化为sp3,H3O+中氧的杂化为sp3;
(5)升华热=范德华力+氢键,利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能.
解答 解:(1)氧原子外围电子有6个电子,2s能级上有2个电子,2p能级上有4个电子,其外围电子排布图为 ,
,
故答案为: ;
;
(2)H2O分子中的原子数为3,价电子数为10,H2S、NH2-的原子数目均为3,价电子数目均为10,则与水互为等电子体,故答案为:H2S、NH2-;
(3)A、常温纯水pH=7,水电离时吸热过程,升温平衡正向进行,溶液pH减小,如100℃,纯水pH=6,故A错误;
B、水分子只含有H-O极性键,水分子为V型,构成的极性分子,故B正确;
C、水在化学反应中化合价可以升高也可以降低,所以可以作氧化剂,也可以作还原剂,故C正确;
D、水分子中无双键,所以无π键,故D错误;
故选BC;
(4)A.水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A错误;
B.水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B正确;
C.因结构不同,则性质不同,微粒的化学性质发生了改变,故C正确;
D.水分子为V型,未成键电子对为2对,H3O+为三角锥型,未成键电子对为1对,所以微粒中未成键电子对发生了改变,故D正确;
故答案为:A;
(5)冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol,
故答案为:20.
点评 本题考查物质结构与性质,明确原子序数、电子排布、等电子体、空间构型、分子极性的判断等知识即可解答,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,21g氧气和27g臭氧所含氧原子总数为3NA | |
| B. | 34gH2O2中含阴离子数为NA | |
| C. | 饱和FeCl3溶液加入沸水中,若有1molFeCl3水解,可生成NA个胶体粒子 | |
| D. | 80mL10mol/L浓盐酸与足量MnO2加热反应,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 过渡元素是副族和第Ⅷ族元素的总称 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti属于同种元素 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的质量数相同 | |
| C. | ${\;}_{22}^{48}$Ti的相对原子质量约为48 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为不同的核素,互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com