
| Ԫ�ش��� | A | B | C | D | E |
| ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| ��Ҫ���ϼ� | +2 | +3 | +6��-2 | -1 | -1 |
| A�� | A��B�����Ӱ뾶��С��ϵΪB3+��A2+ | |
| B�� | D��E�γɵļ����ӵĻ�ԭ�ԣ�E-��D- | |
| C�� | ��̬�⻯����ȶ��ԣ�HD��H2C | |
| D�� | ����������Ӧ��ˮ��������ԣ�H2CO4��HEO4 |
���� ��Ϊ������Ԫ�أ�C��+6��-2�ۣ�����֪CΪSԪ�أ�A��B���ϼ۷ֱ�Ϊ+2��+3��ԭ�Ӱ뾶A��B������֪AΪMg��BΪAl��D��E���ϼ۾�Ϊ-1�ۣ�ԭ�Ӱ뾶D��E������֪DΪF��EΪCl��
A�����Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС��
B���ǽ�����Խǿ�������ӻ�ԭ��Խ����
C���ǽ�����Խǿ���⻯��Խ�ȶ���
D���ǽ�����Խǿ����ۺ����������Խǿ��
��� �⣺��Ϊ������Ԫ�أ�C��+6��-2�ۣ�����֪CΪSԪ�أ�A��B���ϼ۷ֱ�Ϊ+2��+3��ԭ�Ӱ뾶A��B������֪AΪMg��BΪAl��D��E���ϼ۾�Ϊ-1�ۣ�ԭ�Ӱ뾶D��E������֪DΪF��EΪCl��
A��Mg2+��Al3+���Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��Al3+��Mg2+����A����
B���ǽ�����F��Cl���ǽ�����Խǿ�������ӻ�ԭ��Խ���������ӵĻ�ԭ�ԣ�Cl-��F-����B��ȷ��
C���ǽ�����F��S���ǽ�����Խǿ���⻯��Խ�ȶ������⻯���ȶ���HF��H2S����C����
D���ǽ�����Cl��S����ۺ���������ԣ�H2SO4��HClO4����D����
��ѡB��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã����ض�Ԫ�������ɵĿ��飬����ԭ�Ӱ뾶�뻯�ϼ��ƶ�Ԫ���ǽ���ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
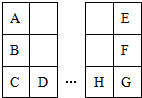 A��HԪ����Ԫ�����ڱ��е����λ����ͼ��A��E��ԭ���������3��E��һ�ֵ�������Ȼ����Ӳ���������ʣ�D��H��ͬ����Ԫ�أ������ж���ȷ���ǣ�������
A��HԪ����Ԫ�����ڱ��е����λ����ͼ��A��E��ԭ���������3��E��һ�ֵ�������Ȼ����Ӳ���������ʣ�D��H��ͬ����Ԫ�أ������ж���ȷ���ǣ�������| A�� | ԭ�Ӱ뾶��H��F��E | |
| B�� | �����ԣ�A��B��D | |
| C�� | C��G��ԭ�Ӻ�����������3 | |
| D�� | B�ĵ����ڿ�����ȼ������ֻ�����Ӽ��Ļ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ѹǿ����߷�Ӧ���� | B�� | �����¶ȿɼ�С��Ӧ���� | ||
| C�� | �ﵽƽ��ʱ��v������=v���棩=0 | D�� | �ﵽƽ��ʱ��NO2ת����Ϊ100% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ʾij���ӵĽṹʾ��ͼ��
��ʾij���ӵĽṹʾ��ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 Cu2S�ǻ���ͭһ����Ҫ��ԭ�ϣ���������Cu2Sұ��ͭ����ȡCuSO4•5H2O������ͼ��
Cu2S�ǻ���ͭһ����Ҫ��ԭ�ϣ���������Cu2Sұ��ͭ����ȡCuSO4•5H2O������ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʯ��ˮ��ϡ���ᷴӦ��Ca��OH��2+2H+=Ca2++2H2O | |
| B�� | ����������Һ��ϡ����ķ�Ӧ��OH-+H+=H2O | |
| C�� | ��FeCl3��Һ��ʴӡˢ��·����ͭ����2Fe3++Cu=2Fe+Cu2+ | |
| D�� | ̼�������ϡ�����У�CaCO3+2H+=Ca2++H2O+CO2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com