
| ��� | �� | �� | �� | �� |
| V[FeCl3��aq��]/mL | 50 | 50 | 50 | 50 |
| ��Ϸ�ĩ����/g | 1.2 | 2.4 | 3.6�� | 4.8 |
| ��Ӧ��ʣ���������/g | 0 | 0.64 | 1.92 | 3.12 |
| A���ڢ��鷴Ӧ����Һ��ʣ��c��Fe3+��=0.4mol/L |
| B���ڢڡ�����ʣ�����ȫ��ͭ |
| C���ڢ������Һ��c��Fe2+��=2.0mol/L |
| D��ԭ��Ϸ�ĩ��n��Fe����n��Cu��=1��2 |
1.2g��
| ||
| 56g/mol |
| 1.2g-56g/mol��0.01mol |
| 64g/mol |
| 1.2mol/L��0.05L-0.04mol |
| 0.05L |
| 0.09mol |
| 0.05L |
| 7 |
| 56 |
| 8 |
| 64 |


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Fe2O3���ڹ�����������У�Fe2O3+6H+=2Fe3++3H2O |
| B������������Һ��������������Һ�����ԣ�Ba2++2OH-+2H++SO42-=BaSO4��+2H2O |
| C���������ƺ�������ϡ�����ϣ�SO32-+2H+=SO2��+H2O |
| D������������Һ�м����������ữ�Ĺ���������Һ��Fe2++2H++H2O2=Fe3++3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A����ҺA�е�������ΪFe2+��Fe3+��H+ |
| B����Ʒ��FeԪ�ص�����Ϊ2.24 g |
| C����Ʒ��FeԪ�ص�����Ϊ2.49 g |
| D����ƷCuO������һ��Ϊ4.0 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��33.3% | B��25% |
| C��50% | D��75% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
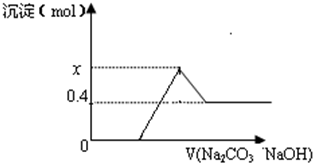 ������̼��������ˮ���ҷ�Ӧ��������Ӧ�����������̬�����磺
������̼��������ˮ���ҷ�Ӧ��������Ӧ�����������̬�����磺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
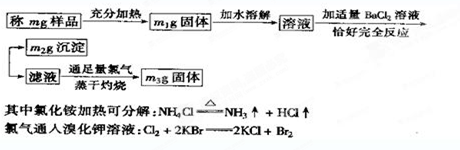
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2��3 | B��3��3 |
| C��3��1 | D��1��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��25% | B��34% |
| C��75% | D��50% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com