
| A. | 0.2 mol H2O2完全分解转移的电子数为0.4 NA | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA | |
| D. | 在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA |
分析 A、双氧水的分解为歧化反应;
B、在质量分数为98%的浓硫酸中,除了硫酸,水也含H原子;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、氮气和CO的摩尔质量均为28g/mol,且两者均含14个电子.
解答 解:A、双氧水的分解为歧化反应,1mol双氧水分解转移1mol电子,故0.2mol双氧水分解转移0.2NA个电子,故A错误;
B、在质量分数为98%的浓硫酸中,除了硫酸,水也含H原子,故溶液中含有的H原子的个数多于36.8NA个,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故2.24L混合气体的物质的量小于0.1mol,则含有的氧原子个数小于0.2NA个,故C错误;
D、氮气和CO的摩尔质量均为28g/mol,故2.8g氮气和2.8gCO的物质的量均为0.1mol,且两者均含14个电子,故0.1mol氮气和0.1molCO中均含1.4NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 重金属、农药等会造成水体污染 | |
| B. | 装饰材料中的甲醛、苯等会造成居室污染 | |
| C. | CO会导致酸雨的形成 | |
| D. | CO2的大量排放会加剧温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x>y | B. | x<y | C. | x=y | D. | x≤y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2g O2和3.2g O3所含氧原子数都是0.2NA | |
| B. | 常温下,0.1mol•L-1NH4NO3溶液中,含有的氮原子数是0.2NA | |
| C. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA | |
| D. | 2.24LCO和CO2的混合气体中所含的碳原子数一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的洗涤液未转入容量瓶中 | |
| C. | 往烧杯中转移溶液时有少量液体溅出 | |
| D. | 定容时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
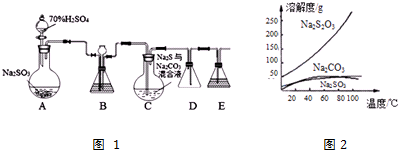
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com