
(1)请在下图所示分子的结构简式中用“*”标记出手性碳原子。若用该有机物进行核磁共振实验,所得核磁共振氢谱有________个峰,强度比为________。

(2)已知某硼烷相对分子质量为28,核磁共振氢谱有两个峰且强度比为1∶2,则该硼烷的分子式是________,已知该硼烷气体在空气中能剧烈燃烧生成三氧化二硼和水,且生成1 mol液态水可放出722 kJ的热量,请写出燃烧的热化学方程式:____________________________。
(1)
 6 3∶1∶1∶1∶1∶1
6 3∶1∶1∶1∶1∶1
(2)B2H6 2B2H6(g)+6O2(g) 2B2O3(s)+6H2O(l)
ΔH=-4 332 kJ·mol-1
2B2O3(s)+6H2O(l)
ΔH=-4 332 kJ·mol-1
【解析】
试题分析:(1)手性碳原子所连的四个基团都是不同的,故该分子中共有2个手性碳原子,即  ,该分子中共有6类氢原子,且个数比为3∶1∶1∶1∶1∶1。(2)硼烷中只含有B和H两种元素,由于峰的强度比为1∶2,故分子中的氢原子数为3的倍数,故相对分子质量为28的硼烷的分子式为B2H6,1 mol B2H6燃烧生成3 mol H2O,故热化学方程式为2B2H6(g)+6O2(g)
,该分子中共有6类氢原子,且个数比为3∶1∶1∶1∶1∶1。(2)硼烷中只含有B和H两种元素,由于峰的强度比为1∶2,故分子中的氢原子数为3的倍数,故相对分子质量为28的硼烷的分子式为B2H6,1 mol B2H6燃烧生成3 mol H2O,故热化学方程式为2B2H6(g)+6O2(g) 2B2O3(s)+6H2O(l) ΔH=-4 332 kJ·mol-1。
2B2O3(s)+6H2O(l) ΔH=-4 332 kJ·mol-1。
考点:考查氢的种类和有机反应热化学方程式的书写。


科目:高中化学 来源: 题型:阅读理解
| 49n |
| 9m |
| 49n |
| 9m |
查看答案和解析>>
科目:高中化学 来源:2013届湖北省部分重点中学(天门中学等)高三上学期期中联考化学试卷(带解析) 题型:填空题
(17分)人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+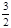 O2(g) △H="+765.0kJ" /mol。
O2(g) △H="+765.0kJ" /mol。
Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)。
Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol。
2NH3(g) △H=-93.0kJ /mol。
回答下列问题:
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
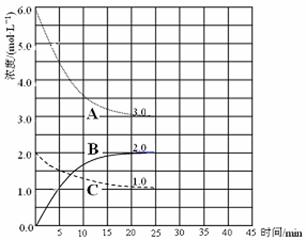
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题: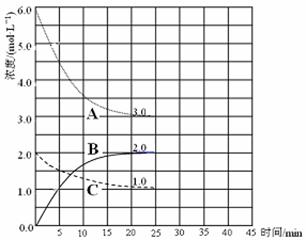
① 表示N2的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省浙北名校联盟高三上学期期中联考化学试卷(解析版) 题型:实验题
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应只生成CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成一种Cu(OH)2沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。
(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的离子反应方程式为: _ ;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为 ①过滤②洗涤③干燥。
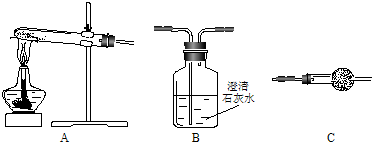
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

(1)各装置连接顺序为 
 。
。
(2)装置C中装有的试剂名称是 。
(3)按你的装置连接顺序,甲的猜想是正确的,则可通过________________________现象来说明甲的猜想是正确的。
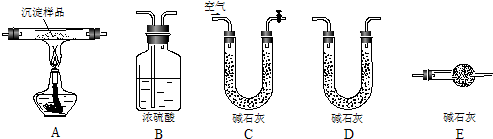
Ⅲ.若CuCO3和Cu(OH)2两者都有,丙同学通过装置Ⅰ进行定量分析来测定其组成。

(1)实验有关操作为:①往锥形瓶中放入适量的样品:②从分液漏斗往锥形瓶中加入过量的稀硫酸;③检验装置的气密性;④测定收集到水的体积。
正确的操作顺序为____________________。
(2)广口瓶中水的上面覆盖了一层植物油,若瓶中的液体没有装满(上方留有少量空间),实验测得CO2的体积将___________(填偏大、偏小或不变)。
(3)若实验中测得样品的质量为wg,气体的体积为aL(标况下),则样品中CuCO3的质量分数为___________(CuCO3的式量为124)。
(4)丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大。建议改用图中的Ⅱ、III装置进行实验。只需进行简单而又必要的数据测定,可比较准确地确定样品中CuCO3的质量分数,较合理的装置_______(填代号)。但是丁同学的装置仍然有缺陷,所测结果将偏高或偏低__________。理由是___________________________
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省(天门中学等)高三上学期期中联考化学试卷(解析版) 题型:填空题
(17分)人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+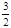 O2(g)
△H=+765.0kJ /mol。
O2(g)
△H=+765.0kJ /mol。
Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)。

Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g)
△H=-93.0kJ /mol。
2NH3(g)
△H=-93.0kJ /mol。
回答下列问题:
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
① 表示N2 的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2 的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2 浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。
查看答案和解析>>
科目:高中化学 来源:2015届新疆布尔津县高中高一分班考试化学试卷(解析版) 题型:实验题
(13分)过氧化钠(化学式为NaNa2O2)可用在呼吸面具中作为氧气来源。Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O = 4NaOH+O2↑。以下是某兴趣小组进行的探究活动。
(1)利用如下图所示实验装置制取氧气,请回答有关问题。
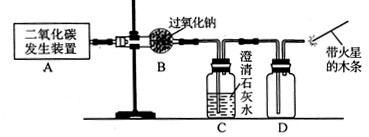
①实验室制取CO2的化学方程式为 。
②表明CO2未被Na2O2完全吸收的实验现象为 。
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的 性质。
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验。
①有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是 。
②同学们通过讨论和实验证明了X是Na2CO3。以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整。
|
实验操作 |
现 象 |
有关的化学方程式 |
|
实验一:取少量固体样品,
|
澄清石灰水变浑浊 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
|
实验二:取少量固体样品, 加水配成溶液,滴加适量的 溶液 |
有白色沉淀产生
|
|
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com