
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
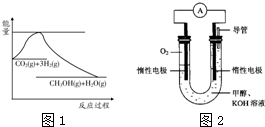 (2012?通州区一模)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:
(2012?通州区一模)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应条件 | 主要产物 | 生成1mol有机物 △H/kJ?mol-1 |
| Cu-ZnO-Cr2O3-MnO,200~400℃,30~40MPa | 甲醇 | -128 |
| Ni,250~500℃,常压 | 甲烷(和水蒸气) | -206.2 |
| FeO-Co-Ni,150~350℃,0.1~3MPa | 人造石油 | |
| Ru,150~250℃,10~100MPa | 固态烷烃 | |
| ThO-ZnO-Al2O3,400~500℃,10~100MPa | 异丁烷、异戊烷 | |
| Co-Fe,100~200℃,10~20MPa | 含氧有机化合物 | |
| Rh原子簇配合物,高压液相 | 乙二醇 (少量乙酸、乙醇) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com