
短周期主族元素X、Y、Z、W的原子序数依次增大,且只有一种元素为金属元素。其中X、Z同主族.X、Y、Z的原子最外层电子数之和为15,则下列说法错误的是
A. Y、z、W一定同周期 B. 简单氢化物稳定性:X>Z
C. X、Y组成的化合物具有两性 D. 离子半径大小:Z>W>Y>X
科目:高中化学 来源:2017届湖北省黄冈市高三3月质量检测理科综合化学试卷(解析版) 题型:选择题
下表为元素周期表中短周期的一部分,其中Y元素的原子序数为M与N元素原子序数之和。下列说法正确的是
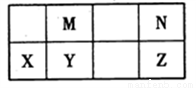
A. 氢化物的稳定性:N >Z,是因为其氢化物分子可形成氢键
B. 元素的非金属性:M > Y,是因为单质M能与YN2反应生成单质Y
C. 熔沸点:YN2>MN2,是因为YN2的分子间作用力强
D. 简单离子的半径:N >X,是因为它们具有相同的电子层结构且X的核电荷数更大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:简答题
Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为________。
(2)实验①反应后的溶液中由水电离出的c(OH-)=________mol·L-1;x________0.2mol·L-1(填“>”“<”或“=”)。
(3)下列关于实验②反应后的溶液说法不正确的是________(填字母)。
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式________。
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
室温下,分别把下列物质加入水中,能使水的电离程度增大且所得溶液呈酸性的是
A. K2SO4 B. NaHSO4 C. NaClO D. NH4NO3
查看答案和解析>>
科目:高中化学 来源:2017届江西省南昌市高三第一次模拟考试理综化学试卷(解析版) 题型:简答题
研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下: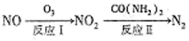
已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则反应I的热化学方程式为________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) △H>0,请你分析该设想能否实现?______(填“是”或“否”) ,依据是_____________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
① 甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因___________。
② 向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈______性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为______________。
(4)活性炭也可用于处理汽车尾气中的NO。在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
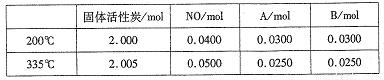
①该反应的正反应为________(填”吸热”或“放热”)反应。
② 200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将_____。(填“增大”、“减小”或“不变”)。
③计算反应体系在335℃ 时的平衡常数_______。
查看答案和解析>>
科目:高中化学 来源:2017届河南省濮阳市高三第一次模拟考试理综化学试卷(解析版) 题型:推断题
化学•选修5:有机化学基础
有机物H(C25H44O5)是一种新型治疗高血压病的药物,工业上以淀粉、烃A为基本原料合成H的路线如下图所示。
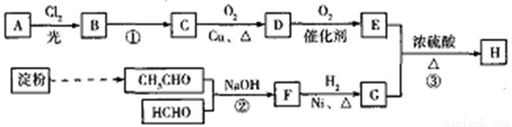
巳知:(i)烃A在质谱图中的最大质荷比为72,B分子中核磁共振氢谱有2个峰且面积比为9:2。
(ii) 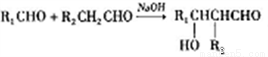 。
。
(iii)反应③中发生反应的E、G物质的量之比为4:1。
(1)A的分子式为_____;B的名称是_______;C的结构简式为_______。
(2)反应②的类型是______;F中的官能团名称是_______。
(3)写出反应①的化学方程式:___________。
(4)E有多种同分异构体,其中满足下列条件的同分异构体共有____种,核磁共振氢谱有4个峰的物质结构简式为__________。
①能发生银镜反应 ②能与单质钠发生反应
(5)1,3-丁二烯是一种重要化工原料,以乙醛为基本原料可制得该烃,请写出相应的转化流程图:__________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省濮阳市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示。下列有关说法正确的是
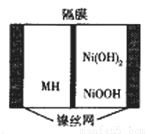
A. 隔膜为阴离子交换膜
B. 电池的电解液可为硫酸
C. 充电时阳极反应为H2O+M+e-=MH+OH-
D. 放电时负极反应为Ni(OH)2+OH—-e-==NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A. 向稀盐酸中加铁粉:2Fe+6H+=2Fe3++3H2↑
B. 碳酸钙溶于稀盐酸中:CO32-+2H+=CO2↑+H2O
C. 氢氧化钡溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.  盐酸与硝酸银溶液反应:Cl-+Ag+=AgCl↓
盐酸与硝酸银溶液反应:Cl-+Ag+=AgCl↓
查看答案和解析>>
科目:高中化学 来源:2017届四川外语学院重庆第二外国语学校高三下学期第二次检测理科综合化学试卷(解析版) 题型:选择题
W、X、Y、Z是四种短周期元素,其原子序数依次增大。已知甲是由其中三种元素组成的化合物,25℃时0.1 mo1.L-1甲溶液的pH为13。X元素的气态氢化物可与其最高价氧化物对应的水化物反应生成盐。下列说法中,正确的是
A. 原子半径大小的比较:r(X)>r(Y)>r(Z)
B. 元素Y、Z的简单离子的电子层结构不同
C. 元素X的简单气态氢化物的热稳定性比元素Y的强
D. 只含W、X、Y三种元素的化合物中,有离子化合物,也有共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com