
下列说法正确的是
A.用冰醋酸、蒸馏水和容量瓶等可以配制pH=1的醋酸溶液
B.在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大
C.反应SiO2(s)+ 3C(s)=SiC(s) + 2CO(g)室温下不能自发进行,则该反应的△H<0
D.对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小
科目:高中化学 来源:2015-2016学年广西河池高中高一下第二次月考化学试卷(解析版) 题型:选择题
价电子数和原子数均相等的微粒叫做等电子体,下列各组微粒属于等电子体是( )
A.CO和CO2 B.CS2和NO2 C.CO2和CS2 D.CO2和SO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:实验题
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
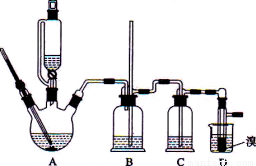
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式_____________________。
(2)装置B的作用是_____________________。
(3)在装置C中应加入___________(填字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用________(填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚.可用_______________的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是_______________。
(7)判断该制备反应已经结束的最简单方法是_____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
2010年,中国首次应用六炔基苯在铜片表面合成了石墨炔薄膜(其合成示意图如图所示),其特殊的电子结构将有望广泛应用于电子材料领域.下列说法不正确的是

A.六炔基苯合成石墨炔属于加聚反应
B.六炔基苯的化学式为C18H6
C.六炔基苯和石墨炔都可发生加成反应
D.六炔基苯和石墨炔都具有平面型结构
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:实验题
KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:
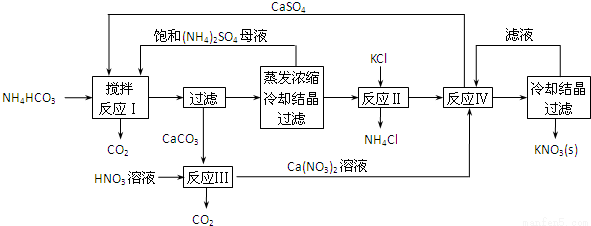
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1:2,该反应的化学方程式为____________。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是____________;从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是____________。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,____________。
(4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
下列有关物质的性质与其应用不相对应的是
A.Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品
B.NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏
C.NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂
D.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第五次模拟理综化学试卷(解析版) 题型:填空题
Q、R、T、W、X、Y、Z为原子序数依次增大的前四周期元素,其中R、T、W是同周期相邻元素,Q、R最外层电子排布可表示为asa,bsbbpa(a≠b):X的基态原子中占据哑铃形原子软道的电子数为10,Y与X为同周期主族元素,基态Z原子核外电子填充在7个能级中,且价层电子有3对成对电子。
(1)四种分子①RY3②TQ4③WQ3④Q2X键角由大到小排列的顺序是_____________(填序号).
(2)微粒W3-的空间构型为_____________。
(3)XTW-的等电子体中属于分子的有_____________(填化学式,写出一种即可),XTW-的电子式为_____________;
(4)R的某种钠盐晶体,其阴离子Mm-(含Q、R、O三种元素)的球棍模型如下图所示:在Mm-中,R原子轨道杂化类型为_____________,m=_____________。(填数字)

(5)T的某种单质的片层与层状结构如图1所示.其中层间距离为xpm,图2为从结构中取出的晶胞,若晶胞的边长为ypm,则T的该种单质的密度为_____________g•cm-3。(1pm=10-12m)

查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:选择题
自然界中金属硫化物之间存在原电池反应。下图所示装置中电极Ⅰ为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转。若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀。下列有关说法中正确的是( )

A.工业上利用该原理富集铁
B.电极Ⅱ作正极
C.溶液流经该装置后pH增大
D.该装置负极的电极反应为FeS2—15e—+8H2O=Fe3++2SO42—+16H+
查看答案和解析>>
科目:高中化学 来源:2016届山西省等校高三下第四次联考理综化学A卷(解析版) 题型:实验题
钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示:
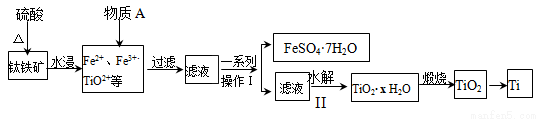
(1)钛铁矿与硫酸反应的化学方程式为 。
(2)加入的物质A为 。
(3)步骤Ⅱ中发生反应的离子方程式为 ;水解过程中需要升高温度,其目的是:①加快反应水解速率 ② 。
(4)由TiO2获得金属Ti可用以下两种方法。
①电解法:以石墨为阳极,TiO2为阴极,熔融CaO为电解质,其阴极的电极反应式为 。
②热还原法:首先将TiO2、氯气和过量焦炭混合,高温反应生成TiCl4;然后用Mg还原TiCl4即可制取Ti。生成TiCl4的反应中,氧化剂与还原剂的物质的量之比为 ;生成Ti的反应需在Ar气氛中,其原因为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com