
| A、0.1mol?L-1CH3COONa溶液:H+、Al3+、Cl-、NO3- |
| B、含有NaNO3的溶液:H+、Fe2+、SO42-、Cl- |
| C、能使甲基橙变红的溶液:K+、Na+、NO3-、Cl- |
| D、由水电离产生的c(H+)=10-12 mol?L-1的溶液:NH4+、SO42-、HCO3-、Cl- |


科目:高中化学 来源: 题型:
| A、1mol12C18O2中,所含的中子数为22NA |
| B、常温下,1Llmol?L-1Na2CO3溶液中所含的CO32-为NA |
| C、58g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| D、常温常压下,足量的Fe在lmolCl2中充分燃烧,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀H2SO4溶液与铁粉反应:2Fe+6H+═2Fe3++3H2↑ |
| B、氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
| C、氢氧化钡溶液与稀H2SO4溶液反应:Ba2++SO42-═BaSO4↓ |
| D、氯化铁溶液与铁粉反应:Fe3++Fe═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
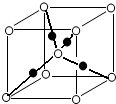 下表为长式周期表的一部分,其中的序号代表对应的元素.
下表为长式周期表的一部分,其中的序号代表对应的元素.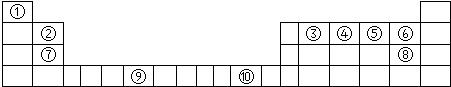
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、Ba2+、NO3-、Cl- |
| B、SO42-、CH3COO-、Al3+、Mg2+ |
| C、K+、Na+、Cl-、SO42- |
| D、NH4+、Ba2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2KMnO4+10HCl(浓)=2 MnCl2+2KCl+5Cl2↑+8H2O | ||||
| B、HCl+AgNO3═AgCl↓+HNO3 | ||||
| C、Zn+2HCl═ZnCl2+H2↑ | ||||
D、2HCl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
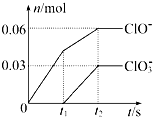 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、反应中转移电子的物质的量是0.21 mol |
| B、ClO3-的生成是由于温度升高引起的 |
| C、苛性钾溶液中KOH的质量是16.8 g |
| D、氯气被还原成0.06 mol ClO-和0.03 mol ClO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com