
| A. | 铝粉与氧化铁的反应 | B. | 氯化铵晶体与Ba(OH)2•8H2O的反应 | ||
| C. | 氯酸钾的分解反应 | D. | 盐类的水解反应 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应.
解答 解:A.铝粉与氧化铁的反应是放热反应,故A正确;
B.氯化铵晶体与Ba(OH)2•8H2O的反应是吸热反应,故B错误;
C.氯酸钾的分解反应是吸热反应,故C错误;
D.盐类的水解反应是吸热反应,故D错误.
故选A.
点评 本题考查放热反应,难度不大,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


科目:高中化学 来源: 题型:选择题
| A. | 医学上,血液透析是利用了胶体的渗析原理 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 二氧化硅是人类将太阳能转换为电能的常用材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| B. | 1 molFe与足量的Cl2反应转移的电子数为2NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,22.4 LSO3含有的原子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
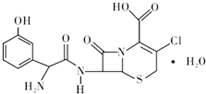 头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )
头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )| A. | 其分子式可以表示为C15H16ClN3O6S | |
| B. | 该物质具有两性 | |
| C. | 1 mol该化合物与NaOH溶液作用时消耗NaOH的物质的量最多为 4 mol | |
| D. | 该物质遇FeCl3溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变和熵变都与反应的自发性有关,又都不能独立地作为自发性的判据 | |
| B. | -10℃的液态水就会自动结冰成为固态,因为这是熵增的过程 | |
| C. | 大量事实告诉我们,过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率 | |
| D. | 放热反应过程中体系能量降低,因此有自发进行的倾向,但是有些吸热反应也可以自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 20℃ | 60℃ | 100℃ |
| Na2Cr2O7 | 73.2 | 82.0 | 91.4 |
| K2Cr2O7 | 13.1 | 50.5 | 96.2 |
| NaCl | 36 | 37 | 39 |
| KCl | 34 | 45.5 | 56.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com