
| 物质 | 杂质 | 试剂 | 主要操作 |
| SiO2 | Fe2O3 | ______ | ______ |
| CO2 | CO | ______ | ______ |
| NaCl | MgCl2 | ______ | ______ |
| Cl2气体 | HCl | ______ | ______ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:问答题
| 3 |
| 73 |
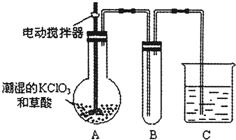
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
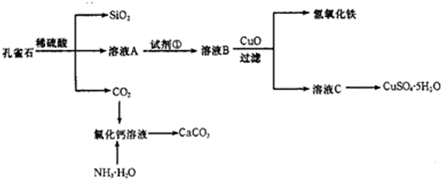
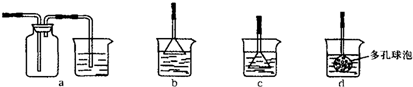
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
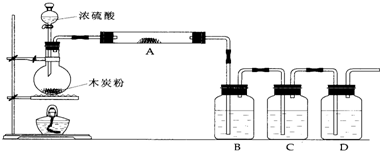
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

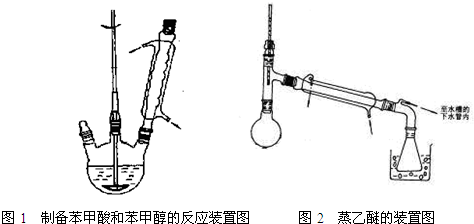
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 使用说明书 | |
| 主要成分 | 活性分子碘含量:1.5mg/片 |
| 贮藏 | 遮光、密闭、在阴凉处保存 |
| 有效期 | 二年 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
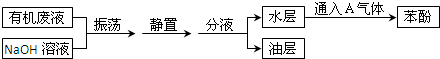
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
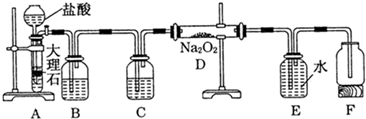
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
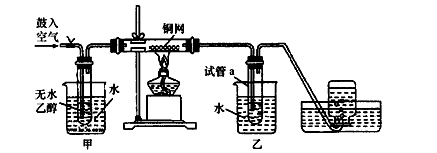
| A.水 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com