
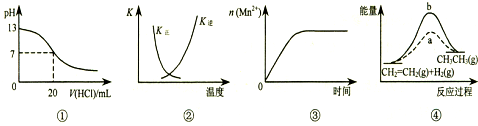
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
分析 根据图象中纵横坐标的含义,利用点、线来分析一个量发生变化随另外一个量如何变化,若变化趋势与图象中变化趋势一致,即为正确答案.
A、酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大;
B、放热反应,升高温度,K减小,正逆反应的平衡常数互为倒数关系;
C、反应生成的Mn2+对该反应有催化作用;
D、反应物的总能量大于生成物的总能量,反应是放热反应,反之是吸热反应.
解答 解:A、0.1mol•L-1NaOH溶液的pH为13,用0.1mol•L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;
B、因反应为放热反应,则升高温度,平衡逆向移动,升温K逆应该增大,而K正应该减小,且正逆反应的平衡常数互为倒数关系,故B正确;
C、该反应是放热反应,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,不是恒定速率,故C错误;
D、因该反应是放热反应,应反应物的总能量大于生成物的总能量,但图象描述是吸热反应,故D错误.
故选B.
点评 本题结合图象考查了中和滴定、化学平衡移动、氧化还原反应、反应中的能量变化,这些知识点是新课程改革考查的重点,明确考点“形变神不变”,做到善于抓规律.


科目:高中化学 来源: 题型:解答题

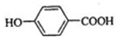 ;
; ,该反应类型为取代反应;
,该反应类型为取代反应; (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
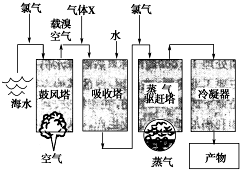 如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题:
如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl是电解质,所以NH4C1在溶液通电时可以电离 | |
| B. | A1(OH)3是两性氢氧化物,所以不能用过量的氨水与铝盐制备 | |
| C. | 用FeCl3溶液制作印刷电路板的原因是Fe3+具有氧化性 | |
| D. | Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向澄清石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向Ca(ClO2)溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+Ba2-+2OH-=BaCO3↓+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 用惰性电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| B. | 稀盐酸和硅酸钠溶液反应:SiO32-+2H+═H2SiO3↓ | |
| C. | 碳酸钙和稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com