
分析 (1)KClO3中氯元素化合价由+5价降低为Cl2中0价,化合价降低5价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为10,故KClO3系数2,再结合原子守恒,配平各物质的系数.
(2)H2O2中氧元素化合价由-1价降低为H2O中-2价,化合价降低2价;Cr2(SO4)3中铬元素化合价由+3价升高为K2CrO4中+6价,化合价升高6价,化合价升降最小公倍数为6,故Cr2(SO4)3系数1,再结合原子守恒,配平各物质的系数.
(3)高锰酸钾有强氧化性,作氧化剂,H2C2O4中C的化合价为+3价,CO2中C的化合价为+4价,H2C2O4作还原剂,由高锰酸钾生成硫酸锰Mn元素化合价降低5,据氧化还原反应中电子得失守恒,再结合反应前后元素守恒配平化学方程式.
解答 解:(1)KClO3中氯元素化合价由+5价降低为Cl2中0价,化合价降低5价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为10,故KClO3系数2,结合K原子守恒,KCl系数为2,结合O原子守恒,H2O系数为3,结合H原子守恒,HCl系数为6,结合Cl原子守恒,Cl2系数为4.
故答案为:2;6;2;4;3
(2)H2O2中氧元素化合价由-1价降低为H2O中-2价,化合价降低2价;Cr2(SO4)3中铬元素化合价由+3价升高为K2CrO4中+6价,化合价升高6价,化合价升降最小公倍数为6,故Cr2(SO4)3系数1,H2O2系数3,再结合Cr原子守恒,
则K2CrO4系数为2,根据SO42-守恒,则K2SO4系数为3,根据K原子守恒,则KOH系数为10
故答案为:3;1;10;2;3;8
(3)该反应中化合价的变化为:KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,所以得失电子的最小公倍数为10,所以KMnO4的计量数为2,K2C2O4的计量数为5,其它元素根据原子守恒配平化学方程式为.2KMnO4+5H2C2O4+3H2SO4=10CO2+1K2SO4+2MnSO4+8H2O
反应2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O中KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,反应中KMnO4为氧化剂,H2C2O4为还原剂,用双线桥法表示下列反应中电子转移的方向和数目可表示为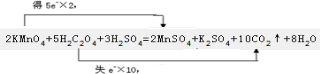 ,
,
故答案为:2;5;3;1;2;10;8; .
.
点评 本题考查了氧化还原反应反应的配平,要以氧化还原反应中得失电子相等为依据配平以及永双线桥表示电子转移的方向和数目.


科目:高中化学 来源: 题型:实验题
| 物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素一定被氧化 | B. | 该元素一定被还原 | ||
| C. | 该元素可能被氧化也可能被还原 | D. | 生成的单质为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 25℃时,0.1mol•L-1Na2S溶液中含有Na+的数目为0.2NA | |
| D. | 将1mL5.68mol•L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6Cl2有4种同分异构体 | |
| B. | 1,4-二甲基苯也称为间二甲苯 | |
| C. | 乙烯使溴水和高锰酸钾溶液褪色的原理相同 | |
| D. | 煤的干馏和石油的分馏均为物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
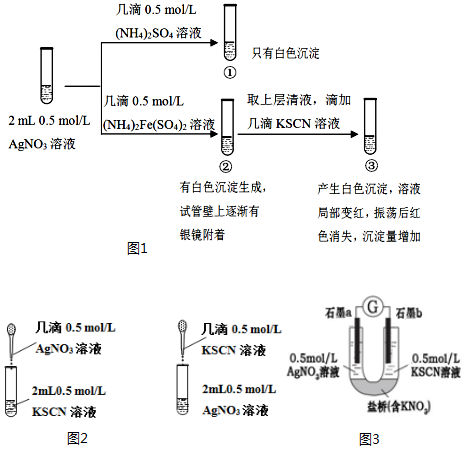
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
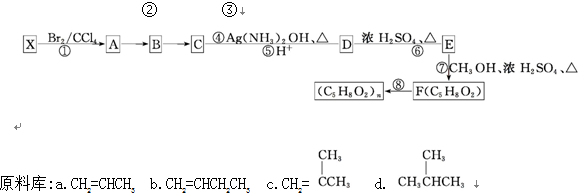
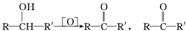 不易被氧化成羧酸
不易被氧化成羧酸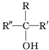 不易被氧化成醛或酮
不易被氧化成醛或酮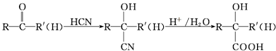
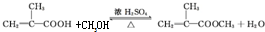 .
.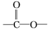 ”结构的共有6种.
”结构的共有6种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com