
| A. | 灼热的炭与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 钢铁制品生锈的反应 |
分析 常见的吸热反应有:Ba(OH)2.8H2O与NH4Cl反应、大多数的分解反应、有碳参加的氧化还原反应等;在化学反应中有元素化合价变化的反应属于氧化还原反应,以此来解答.
解答 解:A.灼热的炭与CO2反应为吸热反应,且该反应中碳元素的化合价发生变化,则属于氧化还原反应,故A选;
B.铁与稀硫酸反应为放热反应,且该反应中铁元素的化合价升高,H元素的化合价降低,属于氧化还原反应,故B不选;
C.Ba(OH)2.8H2O与NH4Cl反应为吸热反应,但该反应中各元素的化合价没有发生变化,故C不选;
D.钢铁制品生锈的反应为放热反应,且该反应中铁元素的化合价升高,O元素的化合价降低,属于氧化还原反应,故D不选;
故选A.
点评 本题考查常见的吸热反应与放热反应及氧化还原反应,学生应注重归纳常见的吸热反应,并熟悉发生的化学反应中是否存在元素的化合价变化来解答即可,难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
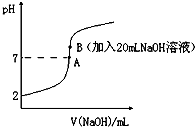 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②⑤ | C. | ③⑤⑥⑧ | D. | ②③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HN3水溶液中微粒浓度大小顺序为:c(H+)>c( N3-)>c(HN3)>c(OH-) | |
| B. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c( N3-)>c(OH-)>c(H+) | |
| C. | HN3与NH3作用生成的叠氮酸铵是强电解质 | |
| D. | N3-与CO2互为等电子体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶于水 | B. | 易挥发,有毒性 | ||
| C. | 苯分子中含有碳碳双键 | D. | 属于烃类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2=2SO3△H=-196.6kJ•mol-1 | |
| B. | N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1 | |
| C. | C(s)+O2(g)=CO2(g)△H=+393.51kJ•mol-1 | |
| D. | H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H=+285.8kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com