
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
科目:高中化学 来源: 题型:
【题目】污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④过滤法。其中属于化学方法的有( )。
A. ①②③ B. ①②④
C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时反应2SO2(g)+O2(g)═2SO3(g)△H=-197kJmol-1,在相同温度下向一密闭容器中加入2molSO2和1molO2,达化学平衡时放出热量为a1kJ;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达化学平衡时放出热量为a2kJ,则下列关系式中正确的是( )
A. 2a2>a1>197 B. 2a2<a1<197 C. 2a2=a1>197 D. 2a2=a1=197
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废液是用稀硝酸腐蚀锌板后得到的 ,某化学兴趣小组拟用该废液(含有少量的Cl-、Fe3+)制取Zn(NO3)2·6H2O的过程如下:
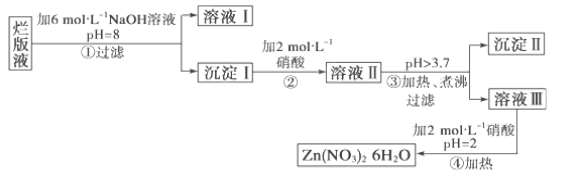
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物Zn(OH)2具有两性,Fe3+在PH=3.7时就能完全沉淀。
(1)该废液溶质的主要成分是________(填化学式)。
(2)在操作①中保持pH=8的目的是______________________。
(3)沉淀Ⅰ的成分是___________________________。
(4)操作③中加热、煮沸的目的是________________________;
(5)操作④保持pH=2的目的是__________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)W原子的核外电子排布式为_________。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为_________、__________、_________,推测盐中阴离子的空间构型为__________,其中心原子杂化方式为__________。
(3)Z、W两种元素电负性的大小关系为____;Y、Z两种元素第一电离能的大小关系为____。
(4)CO的结构可表示为C![]() O,元素Y的单质Y2的结构也可表示为Y
O,元素Y的单质Y2的结构也可表示为Y![]() Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):

①结合数据说明CO比Y2活泼的原因:_____。
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是_____。

A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃)。
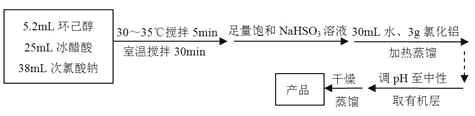
主反应:
回答下列问题:
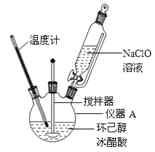
(1)仪器A的名称是 。
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 、 。
(3)加入饱和NaHSO3溶液时发生的主要反应是 (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是 。
(4)为将馏出液的pH调至中性,可以加入的试剂是 。
A.稀盐酸 | B.无水碳酸钠 | C.浓硫酸 | D.氢氧化钠固体 |
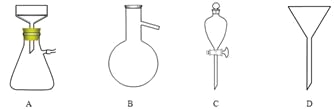
(5)调节pH后还需加入精制食盐,其目的是 ,“取有机层”时使用的主要仪器是 。(填下图对应的字母)。
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构为:有关原花青素的下列说法不正确的( )
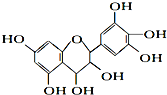
A.该物质既可看作醇类,也可看作酚类
B.1mol该物质可与4mol Br2反应
C.1mol该物质可与7mol Na反应
D.1mol该物质可与7mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组微粒:
A.12C和14C B.O2和O3
C.H、D、T D.金刚石和石墨
E.CH3OH和![]()
F. 和
和![]()
用序号填空:
(1)互为同位素的是______;
(2)互为同素异形体的是______;
(3)互为同分异构体的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com