
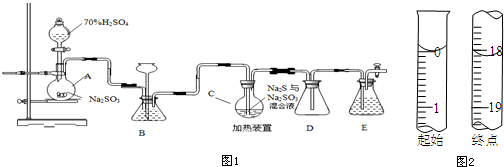
分析 装置A中制备二氧化硫,C中二氧化硫、硫化钠与亚硫酸钠反应生成Na2S2O3,E装置进行尾气处理,防止污染空气,可以盛放氢氧化钠反应,D为安全瓶,防止倒吸,装置B可用来观察SO2的生成速率,也可以根据长颈漏斗中液面变化判断装置是否发生堵塞等作用.
(1)液柱高度保持不变,说明气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用;
(2)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3;
(3)观察SO2的生成速率,则二氧化硫通过溶液不能与SO2反应,有气泡逸出;
(4)通过分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率;
(5)根据C中发生的反应可知,烧瓶C中反应达到终点发生的反应为硫与亚硫酸钠反应生成硫代硫酸钠;
(6)根据图示的滴定管中液面读出初读数、终读数,然后计算出消耗碘的标准溶液体积,根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),然后碘单质的物质的量计算出Na2S2O3•5H2O质量及产品的纯度;产品纯度测量值偏大,粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大.
解答 解:(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)装置A中反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,所以溶液不能与SO2反应,选项中只有饱和NaHSO3溶液与二氧化硫不反应,
故答案为:c;
(4)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,
故答案为:控制滴加硫酸的速度;
(5)根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液变澄清(或混浊消失),
故答案为:溶液变澄清(或浑浊消失);
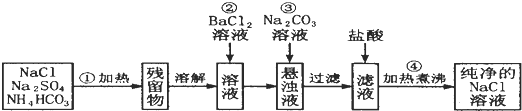
(6)根据图示的滴定管中液面可知,滴定管中初始读数为0.00mL,滴定终点液面读数为18.10mL,所以消耗碘的标准溶液体积为18.10mL-0.00mL=18.10mL;
根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以4.96g产品中含有Na2S2O3•5H2O质量为:0.1000 mol•L-1×18.10×10-3L×2×248g/mol=0.89776g,故则产品的纯度为:$\frac{0.89776g}{4.96g}$×100%=18.1%,经仪器分析,该产品纯度为16%,产品纯度测量值偏大,粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大,
故答案为:18.1%;粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大.
点评 本题考查实验方案的分析与评价,涉及气密性检验、离子检验、对操作的分析评价、化学计算等,侧重实验分析能力及知识综合应用能力的考查,(2)为易错点,也可以利用总反应的分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
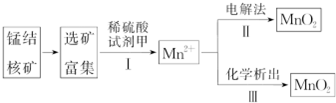
| 实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
| Ⅰ | 5% | 2.0g | 20℃ | |
| Ⅱ | 5% | 1.0g | 20℃ | |
| Ⅲ | 10% | 1.0g | 20℃ | |
| Ⅳ | ω | 2.0g | 30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
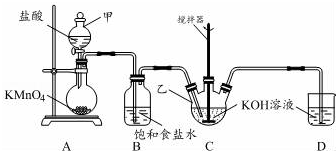 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,则有反应HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3kJ•mol-1 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 已知氧气较臭氧稳定,则3O2(g)═2O3(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液和氯水 | B. | 铁粉和KSCN溶液 | C. | 浓氨水 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com