
【题目】下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
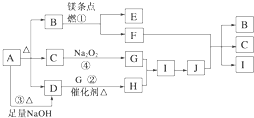
请填写以下空白:
(1)A的化学式________;B的结构式________;D的电子式________;
(2)写出反应①②的化学方程式:
①________________________________________________,
②_________________________________________。
(3)写出反应③的离子方程式:________________________________________。
(4)J与F反应的化学方程式: _________________________________________。
(5)在反应④中,当生成标况下3.36 L G时,转移电子数为__________mol。
【答案】NH4HCO3O=C=O![]() 2Mg+CO2
2Mg+CO2![]() 2MgO+C4NH3+5O2
2MgO+C4NH3+5O2![]() 4NO+6H2ONH4++HCO3-+2OH-
4NO+6H2ONH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2OC+4HNO3(浓)
NH3↑+CO32-+2H2OC+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O0.3
CO2↑+4NO2↑+2H2O0.3
【解析】
A受热能分解,得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,C能和过氧化钠反应,则C为水或二氧化碳,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,C为水,水和过氧化钠反应生成NaOH和O2,D能在催化剂条件下反应生成H,则D是NH3,G是O2,H是NO,I是NO2,J是 HNO3,镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3;据以上分析解答。
A受热能分解,得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,C能和过氧化钠反应,则C为水或二氧化碳,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,C为水,水和过氧化钠反应生成NaOH和O2,D能在催化剂条件下反应生成H,则D是NH3,G是O2,H是NO,I是NO2,J是 HNO3,镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3;
(1) 据以上分析可知:A的化学式NH4HCO3;B为二氧化碳,属于共价化合物,结构式O=C=O;D是NH3,属于共价化合物,电子式:![]() ;综上所述,本题答案是:NH4HCO3,O=C=O,
;综上所述,本题答案是:NH4HCO3,O=C=O,![]() 。
。
(2)镁与二氧化碳反应生成氧化镁和碳,反应①的化学方程式:2Mg+CO2![]() 2MgO+C;氨气和氧气发生催化氧化生成一氧化氮和水,反应②的化学方程式:4NH3+5O2
2MgO+C;氨气和氧气发生催化氧化生成一氧化氮和水,反应②的化学方程式:4NH3+5O2![]() 4NO+6H2O ;综上所述,本题答案是:2Mg+CO2
4NO+6H2O ;综上所述,本题答案是:2Mg+CO2![]() 2MgO+C; 4NH3+5O2
2MgO+C; 4NH3+5O2![]() 4NO+6H2O 。
4NO+6H2O 。
(3)碳酸氢铵与过量的氢氧化钠溶液加热反应生成氨气、碳酸钠和水,反应③的离子方程式:NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O;综上所述,本题答案是:NH4++HCO3-+2OH-
NH3↑+CO32-+2H2O;综上所述,本题答案是:NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O。
NH3↑+CO32-+2H2O。
(4)浓硝酸与碳加热反应生成二氧化碳、二氧化氮和水,反应的化学方程式:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;综上所述,本题答案是:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;综上所述,本题答案是:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。
(5)过氧化钠与水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,反应转移2mole-时,生成氧气1mol,当生成标况下3.36 L 氧气时,即氧气的物质的量为3.36/22.4=0.15mol, 转移电子数为0.3 mol ;综上所述,本题答案是:0.3。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成( )
A. 白、红、白 B. 红、黑、白
C. 红、红、红 D. 白、黑、白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
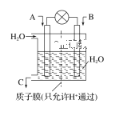
(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为________极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为________________________________________________________________________。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为________________________________________________________________________。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。
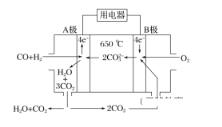
①电池总反应为________________________________________________________________________。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准状况下体积为______ L。电解后溶液体积为2 L,溶液的pH约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH![]() M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:

A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:

(1)非金属性最强的是___(填元素名称),化学性质最不活泼的是____(填元素符号)。
(2)元素①-⑩中半径最大的元素是____(填元素符号)
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是________。(填化学式)
(4)表中能形成两性氢氧化物的元素是______(填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。
(1)Z、M、W三种元素离子半径由大到小的顺序是____(填相应的离子符号)。
(2)用电子式表示M2W的形成过程___________
(3)由M、Z两元素形成的原子个数比为1∶1化合物的化学键类型是______
(4)由X、Y、Z、W四种元素组成的一种盐A,已知:①1molA能与足量NaOH浓溶液反应生成标准状况下22.4L气体。②A能与盐酸反应产生气体B,该气体能与溴水反应。写出A的化学式____,该气体B与溴水反应的离子方程式 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
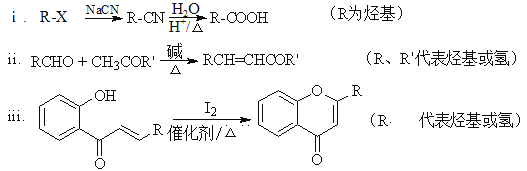
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
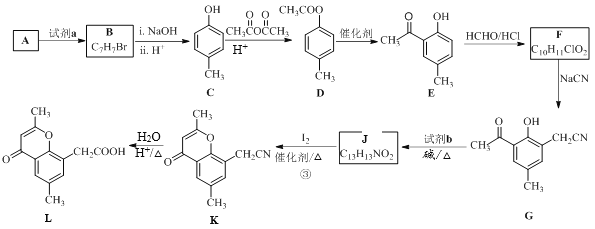
已知部分有机化合物转化的反应式如下:
![]()
![]()
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)试剂a是__________________________。
(3)C→D的化学方程式是__________________________________________。
(4)F的结构简式是__________;试剂b是___________。
(5)H与I2反应生成J和HI的化学方程式是__________________________。
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线______________________。
),参照下列模板写出相应的合成路线______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝原子与氯气反应时失去3个电子,钠原子与氯气反应时失去1个电子,由此得出的下列结论中不正确的是( )
A.铝的活泼性比钠的活泼性强
B.不能说明铝和钠活泼性的强弱
C.在生成的氯化物中钠元素为+1价
D.在生成的氯化物中铝元素为+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
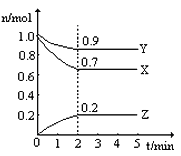
(1)该反应第_______分钟到达平衡状态 。
(2)该反应的化学方程式为____________ 。
(3)2 min时,Y的浓度为___________。
(4)反应开始至2 min,气体X的平均反应速率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com