
【题目】下列反应的离子方程式不正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+ =CO2↑+H2O
C.实验室用浓盐酸与MnO2制备氯气:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
D.过氧化钠与水反应:2Na2O2+2H2O=4OH-+O2↑
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,极易溶于水,不与水反应。若温度过高,二氧化氯的水溶液可能会发生爆炸。某研究性学习小组拟用如下图所示装置制取并收集ClO2(加热和夹持装置均省略)。

(1)在圆底烧瓶中先放入一定量的KClO3和草酸H2C2O4),然后再加入足量的稀硫酸,在60~80℃之间反应生成ClO2、CO2和一种硫酸盐,该反应的化学方程式为________。
(2)装置A中使用温度计的目的是____。反应开始后,可以观察到圆底烧瓶内的现象是_____。
(3)装置B的作用是________。
(4)实验过程中装置D中的溶液里除生成Na2CO3外,还生成物质的量之比为1︰1的另外两种盐,一种为NaClO3,另一种为_______。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液20mL,稀释成100mL试样,量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用 cmol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液V2mL。
已知:2ClO2+8H++10I-==5I2+2C1-+4H2O 2Na2S2O3+I2=Na2S4O6+2NaI
请回答:
①配制100mL步骤3中所需的Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要_______。(填仪器名称)
②步骤3中滴定终点的现象为_______。
③原ClO2溶液的浓度为_______g·L-1(用含字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
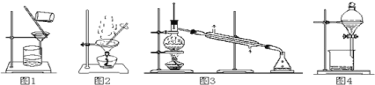
①用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
②用图2所示装置从氯化钠溶液中得到氯化钠晶体
③用图3所示装置从碘的四氯化碳溶液中分离出四氯化碳
④用图4所示装置从乙醇与苯的混合物中分离出苯
A.①②B.②③C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(l)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是________,B原子的杂化轨道类型是_____________。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/ kJ·mol-1 | I2/ kJ·mol-1 | I3/ kJ·mol-1 | I4/ kJ·mol-1 | I5/ kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____ (填元素符号),判断理由为________________________。
(2)铜晶体中铜原子的堆积方式如图24所示,铜晶体中原子的堆积模型属于______。

(3)A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图25所示(黑点代表铜原子)。
①该晶体的化学式为______________________。
②该化合物难溶于水但易溶于氨水,其原因是_______________________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______________________。
③已知该晶体的密度为pg . cm-3,阿伏伽德罗常数为NA,已知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中电负性最大。
(1)试推断A、B、C、D四种元素的符号:A________、B________、C________、D________。
(2)写出A元素原子的核外电子排布式:____________;写出B元素原子核外电子排布的价电子构型:__________;用电子排布图表示C原子的核外电子排布情况:_______________。
(3)比较四种元素的第一电离能和电负性的大小:第一电离能____________;电负性____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物H的合成路线如下:

已知:i. 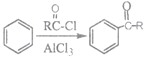
ii. 
回答下列问题
(1)A的化学名称为___________。
(2)B→C的化学方程式为______________________。
(3)E的结构简式为___________;由E生成F的反应类型为______________________。
(4)G中官能团名称为___________;由G→H的化学方程式为______________________。
(5)芳香族化合物L与G的官能团相同,但L的相对分子质量比G小28。则符合下列条件的L的同分异构体有___________种。
①与FeCl3溶液发生显色反应 ②苯环上有3个取代基
(6)按 有机合成路线可以制备
有机合成路线可以制备 。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①写出CO2的电子式__________。
②用饱和Na2CO3溶液做吸收剂可“捕集”CO2。若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式___________。
③聚合离子液体是目前广泛研究的CO2 吸附剂。结合下图分析聚合离子液体吸附CO2的有利条件是__________。

(2)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H =-159.5 kJ/mol
H2NCOONH4(s) △H =-159.5 kJ/mol
第二步:H2NCOONH4(s)![]() CO(NH2)2(s)+ H2O(g) △H =+116.5 kJ/mol
CO(NH2)2(s)+ H2O(g) △H =+116.5 kJ/mol
①写出上述合成尿素的热化学方程式_________。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第______步反应决定,总反应进行到________min时到达平衡。
(3)合成乙酸:
①中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:

原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___。
②根据图示,写出总反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的电子排布式__________
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__________,简要描述该配合物中化学键的成键情况:__________
(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是__________(填序号);在②的分子中有__________个σ键和__________个π键
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
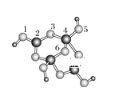
在Xm-中,硼原子轨道的杂化类型有__________;配位键存在于__________原子之间(填原子的数字标号);m=__________(填数字)
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为__________,第二种配合物的化学式为_________ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com