
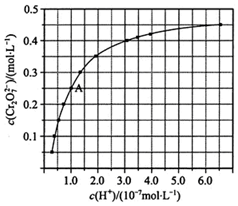
 (1)CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示.
(1)CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示.分析 (1)由图可知,c(H+)越大,c(Cr2O72-)越大,酸性增强利用CrO42-转化为Cr2O72-;且升高温度,溶液中CrO42-的平衡转化率减小,可知升高温度向生成CrO42-的方向移动;
(2)用NaHSO3将废液中的Cr2O72-还原成Cr3+,Cr元素的化合价降低,则S元素的化合价升高,生成硫酸根离子,并结合电荷、电子守恒配平.
解答 解:(1)①用离子方程式表示Na2CrO4溶液中的转化反应为2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
②由图可知,溶液酸性增大,c(Cr2O72-)越大,平衡正向移动,则CrO42-的平衡转化率增大,
故答案为:增大;
③升高温度,溶液中CrO42-的平衡转化率减小,可知升高温度2CrO42-+2H+?Cr2O72-+H2O逆向移动,正反应为放热反应,则该反应的△H小于0,
故答案为:小于;
(2)用NaHSO3将废液中的Cr2O72-还原成Cr3+,Cr元素的化合价降低,则S元素的化合价升高,生成硫酸根离子,由电荷、电子守恒及原子守恒可知离子反应为5H++Cr2O72-+3HSO3-=2Cr3++3SO42-+4H2O,
故答案为:5H++Cr2O72-+3HSO3-=2Cr3++3SO42-+4H2O.
点评 本题考查化学平衡,为高频考点,把握发生的反应、化学平衡移动、图象分析为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2AlCl3(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Al+3Cl2↑ | B. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ | ||
| C. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②③ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
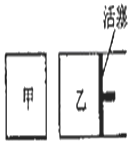 在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )| A. | 无法确定 | B. | a<b | C. | a=b | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2 | B. | Ca(ClO)2 | C. | Ca(OH)2 | D. | HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若AgCl沉淀完全,就是指氯化银溶液中溶质离子的浓度为零 | |
| B. | 达到溶解平衡时,晶体就不再溶解 | |
| C. | 室温下,在100g水中能溶解1~10g的溶质,这种物质被称为可溶性物质 | |
| D. | 无机酸都是可溶的 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( )
是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( )
| A. | B中含有的官能团有溴原子、碳碳双键 | |
| B. | A的结构简式是CH2=CHCH2CH3 | |
| C. | A能使酸性高锰酸钾溶液褪色 | |
| D. | ①②③的反应类型分别为加成反应、取代反应、消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com