
实验室以含有Ca2+、Mg2+、Cl-、SO 、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如
、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如 下:
下:

(1)操作Ⅰ使用的试剂是________,所用主要仪器的名称是________。
(2)加入溶液W的目的是________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是________。酸化溶液Z时,使用的试剂为________。
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8 mol·L-1 |
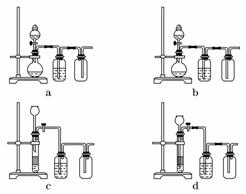
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是________。
(4)常温下,H2SO3的电离常数Kal=1.2×10-2,Ka2=6.3×10-3,H2CO3的电离常数Kal=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于________。
设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论):________________________。仪器自选。
供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
解析:本题考查物质的制备和分离实验,意在考查考生对化学实验的设计和分析能力。(1)操作Ⅰ为萃取、分液,有机层在下层,则选择的试剂为四氯化碳,所用主要仪器为分液漏斗。(2)加入溶液W是为了除去SO ,根据表格提供的数据,当11.0≤pH<12.2时,Mg2+完全沉淀,而Ca2+没有开始沉淀.酸化溶液Z时,使用盐酸不会引入其他杂质。(3)贝壳是块状固体,盐酸是液体,反应进行时不需要加热,且用排空气法收集CO2气体时,导管应“长进短出”,因此选择b、d。(4)该实验设计的错误在于二者的饱和溶液的物质的量浓度不同,可以利用反应:SO2+NaHCO3===CO2+NaHSO3,或比较同浓度的NaHCO3溶液和NaHSO3溶液的碱性等验证H2SO3的酸性强于H2CO3。
,根据表格提供的数据,当11.0≤pH<12.2时,Mg2+完全沉淀,而Ca2+没有开始沉淀.酸化溶液Z时,使用盐酸不会引入其他杂质。(3)贝壳是块状固体,盐酸是液体,反应进行时不需要加热,且用排空气法收集CO2气体时,导管应“长进短出”,因此选择b、d。(4)该实验设计的错误在于二者的饱和溶液的物质的量浓度不同,可以利用反应:SO2+NaHCO3===CO2+NaHSO3,或比较同浓度的NaHCO3溶液和NaHSO3溶液的碱性等验证H2SO3的酸性强于H2CO3。
答案:(1)四氯化碳 分液漏斗 (2)除去溶液中的SO 11.0≤pH<12.2 盐酸 (3)b、d (4)用于比较pH的两种酸的物质的量浓度不相等
11.0≤pH<12.2 盐酸 (3)b、d (4)用于比较pH的两种酸的物质的量浓度不相等
三种参考方案如下:
方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液,用酸度计(或pH试纸)测两溶液的pH,前者的pH小于后者,证明H2SO3酸性强于H2CO3;方案二:将SO2气体依次通过NaHCO3(或Na2SO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,品红溶液不褪色,且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3;方案三:将CO2气体依次通过NaHSO3(或 Na2SO3)溶液、品红溶液,品红溶液不褪色,证明H2SO3酸性强于H2CO3。


科目:高中化学 来源: 题型:
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项( )
| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 甲 |
| D | 酸 | 碱 | 酚酞 | 乙 |

查看答案和解析>>
科目:高中化学 来源: 题型:
在某锂离子电池中,有一种有机聚合物作为 正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:

用相对分子质量为56的单烯烃A合成M的方法可设计如下:

请回答下列问题:
(1)A的结构简式是______________________________________________________,
试剂Ⅱ是__________________,反应Ⅲ的化学反应类型是__________________。
(2)G在一定条件下反应生成的高聚物是制备隐形眼镜的材料,请写出生成该高聚物的化学反应方程式__________________________________________________________。
(3)M与足量氢氧化钠溶液反应的化学方程式是_______________________________
________________________________________________________________________。
(4)在用E制备F的过程中,2分子的E反应会生成一种副产物,其核磁共振氢谱只有一种吸收峰,该副产物的结构简式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学通过系列实验探讨 Mg 及其化合物的性质,操作正确且能达到目的的是( )
A.将水加入浓硫酸中得稀硫酸,置镁片于其中探讨 Mg 的活泼性
B.将 NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C.将 Mg(OH)2 浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D.将Mg(OH)2 沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理、操作或现象不正确的是( )
A.图1锥形瓶中滴入浓盐酸后充满黄绿色气体,试管中出现浅黄色浑浊
B.图2放置一段时间后,饱和CuSO4溶液中出现白色晶体
C.用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色不能说明该溶液中含有钠元素
D.蒸馏时,将温度计水银球靠近蒸馏烧瓶支管口处


查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于NO的叙述不正确的是( )
A.NO对环境的危害在于破坏臭氧层、形成酸雨等方面
B.NO可以是某些含高价N物质的还原产物也可以是某些含低价N物质的氧化产物
C.实验室制取少量的NO可以用向下排空气法收集
D.生物体内存在少量NO能提高其生理机能,如扩张血管、促进免疫力等
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的体积为( )
A.等于50 mL B.大于50 mL C.等于100 mL D.大于100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性条件下1mol KMnO4可将5mol Fe2+ 氧化为Fe3+ ,则 KMnO4被还原的产物为:( )
A:Mn B: Mn2+ C: MnO2 D:KMnO3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C为中学化学中常见单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们有如图所示的转化关系。

回答下列问题。
(1)A、B、C三种单质的组成元素中的任意两种形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
理由是________________________________。
(2)A、B、C三种元素中有一种是金属,则三种元素中可能是金属的是________,理由是_______________________________________。
(3)如果E溶液是一种强酸,写出E作为还原剂参加反应的离子方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com