
【题目】已知:2A(g)+3B(g)![]() 2C(g)+zD(g),现将2 mol A与2 mol B混合于2 L的密闭容器中,2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
2C(g)+zD(g),现将2 mol A与2 mol B混合于2 L的密闭容器中,2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
A. v(C)=0.2 mol·L-1·s-1 B. z=1
C. B的转化率为25% D. C平衡时的浓度为0.5mol·L-1
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
【题目】在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以有机物A合成聚酯类高分子化合物F的路线:

已知:
回答下列问题:
(1)A生成B的反应类型为_____,C中的官能团名称为________。
(2)D与NaOH水溶液反应的化学方程式为________。
(3)①E生成F的化学方程式为________。
②若F的平均相对分子质量为20000,则其平均聚合度为________。(填字母)
A.54 B.108 C.119 D.133
(4)E在一定条件下还可以合成含有六元环状结构的G。G的结构简式为________。
(5)满足下列条件的C的同分异构体有_____种。(不考虑立体异构)
①含有1个六元碳环且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与斐林试剂反应产生2mol砖红色沉淀
(6)写出用![]() 为原料制各化合物
为原料制各化合物 的合成路线______。(其他试剂任选)
的合成路线______。(其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳总结是学习化学的一种方法。
(1)甲同学发现A、B、C三种物质有如图l所示的相互反应关系,“—”表示能反应(部分反应物、生成物以及反应条件省略,下同)。

已知A是常见金属,人体缺乏A元素易患贫血症;B是胃酸的主要成分;B与C反应产生不溶于稀硝酸的白色沉淀,则A是____(填化学式,下同),C是_______。请写出下列反应的化学方程式:A与B________________;B与C____________________。
(2)乙同学发现X、Y、Z三种物质有如图2所示的循环转化关系“→”表示能转化。
①若X、Y、Z均为含钙化合物,X是一种常用干燥剂,Y俗称熟石灰。则X的化学式为______;请写出Y→Z的反应化学方程式________________。
②若X是碳单质,Y、Z是含有碳元素的氧化物,X、Y、Z的相对分子质量依次增大,则Y的相对分子质量为___;Z→X可通过以下反应实现:___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
则5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
温度降低时,反应①的平衡常数将______________(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=__________________________。
(3)碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g)![]() WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。

① 该反应△H____________0(填“>”或“<”)。
② 反应从开始到t1(t1= 3 min)时间内 I2 的平均反应速率v(I2)=_________。
③ 在450℃时,该反应的平衡常数K的值为__________________。
④ 能够说明上述反应已经达到平衡状态的有________________ (填选项字母)。
A.I2与WI2的浓度相等 B. 容器内各气体的浓度不再改变
C. 容器内混合气体的密度不再改变 D.容器内气体压强不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业中铝、铁、铜的合金废料的再利用,某同学设计了如下回收方案:
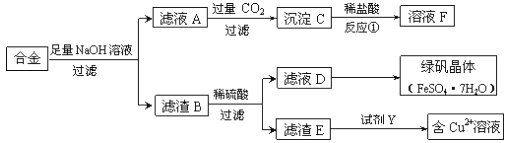
(1)操作①的名称是______________,滤渣B含有_______________(填化学式)。
(2)反应①的离子方程式是_________________________________。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作是______________、冷却结晶、过滤、自然干燥,这一系列操作中没有用到的仪器有________(填序号)。
A.漏斗 B.坩埚 C.烧杯 D.玻璃棒
(4)试剂Y应该是一种________(填“氧化剂”或“还原剂”),它不可能是____(填序号)。
A.过氧化氢 B.氢气 C.氧气 D.铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为7种短周期主族元素,其原子序数依次增大。A、C可形成A2C和A2C2两种化合物,B的最高正化合价与最低负化合价的绝对值之差为2,D和A同主族,E是地壳中含量最高的金属元素,F和C同主族且可形成FC2和FC3两种化合物。
(1)G的元素名称是__________,它在元素周期表中的位置是______________。
(2)F的质子数和中子数相等,F的原子组成符号为______,它的最高价为____价。
(3)C、D可形成一种淡黄色固体化合物,写出此化合物的电子式__________。
(4)由上述7种元素中的4种元素组成的化合物X,X既能与热的NaOH溶液反应,也能与稀盐酸反应,且均能生成无色气体,X的化学式是____________________。
(5)已知Se在第四周期,与S同主族,请任意写出一种含Se物质的化学式,预测其性质,并说明预测依据_______。
含Se物质化学式 | 性质 | 预测依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成金刚石的新方法化学原理为:①Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平);方法比人工首次制得金刚石的旧方法:②C(石墨)=C(金刚石)容易得多。以下表述中正确的是
C(金刚石)+C(石墨)+Na2CO3(未配平);方法比人工首次制得金刚石的旧方法:②C(石墨)=C(金刚石)容易得多。以下表述中正确的是
A. 反应②中既有旧化学键的断裂又有新化学键的形成
B. 新方法利用的是化学变化,旧方法利用的是物理变化
C. 在反应①中每生成12 g金刚石需要消耗46 g金属钠
D. 反应①和反应②中所得的金刚石都是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com