
����Ŀ��4���������������Ԫ�ص����λ�������Ԫ��X��ԭ�Ӻ����������M��2����Y��������������ԡ��ش��������⣺
![]()
��1��Ԫ��X�����ڱ��е�λ���ǵ�________���ڡ���________�壬�䵥�ʿɲ��õ������________�ķ����Ʊ���
��2��M��N��Y����Ԫ������������Ӧ��ˮ�����У�������ǿ����____________��������ǿ����______��(�ѧʽ)
��3���������(MN)2�ĵ���ʽΪ___________��(MN)2��Ϊ��±�أ�������±�����ƣ���������������Һ��Ӧ�Ļ�ѧ����ʽΪ________
���𰸡��� ��A MgCl2 HNO3 Al(OH)3 ![]() 2NaOH��(CN)2===NaCN��NaOCN��H2O
2NaOH��(CN)2===NaCN��NaOCN��H2O
��������
������Ԫ��Y��������������ԣ����Y��AlԪ�أ�����Ԫ�����λ�ÿ����жϣ�XΪMgԪ����M��CԪ����N��NԪ�أ��Դ˽��
������Ԫ��Y��������������ԣ����Y��AlԪ�أ�����Ԫ�����λ�ÿ����жϣ�XΪMgԪ����M��CԪ����N��NԪ����
��1��XΪMg�������ڱ��е�λ���ǵ������ڵڢ�A�壬�䵥�ʿɲ��õ������MgCl2�ķ����Ʊ���
�ʴ�Ϊ��������A�� MgCl2��
��2��Al��N��C����Ԫ������������ˮ������������ǿ����HNO3��������ǿ����Al(OH)3��
�ʴ�Ϊ��HNO3��Al(OH)3��
��3��(CN)2�ĵ���ʽΪ![]() ��������������±�����ƣ���˿����Ʋ���������������Һ��Ӧ�ķ���ʽΪ2NaOH��(CN)2===NaCN��NaOCN��H2O��
��������������±�����ƣ���˿����Ʋ���������������Һ��Ӧ�ķ���ʽΪ2NaOH��(CN)2===NaCN��NaOCN��H2O��
�ʴ�Ϊ��![]() ��2NaOH��(CN)2===NaCN��NaOCN��H2O��
��2NaOH��(CN)2===NaCN��NaOCN��H2O��


 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3�������Ϊ1 L�ĺ����ܱ������з�����Ӧ��SO2(g)��2NO(g)![]() 2NO2(g)��S(s)���ı�����I�ķ�Ӧ�¶ȣ�ƽ��ʱc( NO2)���¶ȵĹ�ϵ����ͼ��ʾ������˵����ȷ����
2NO2(g)��S(s)���ı�����I�ķ�Ӧ�¶ȣ�ƽ��ʱc( NO2)���¶ȵĹ�ϵ����ͼ��ʾ������˵����ȷ����

���� ��� | �¶�/K | ��ʼ���ʵ���/mol | |||
SO2 | NO | NO2 | S | ||
�� | 0.5 | 0.6 | 0 | 0 | |
�� | T1 | 0.5 | 1 | 0.5 | 1 |
�� | T2 | 0.5 | 0.2 | 1 | 1 |
A. �÷�Ӧ�Ħ�H<0
B. T1ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ![]()
C. �����������������T1ʱ�ﵽƽ�⣬��ѹǿ֮��С��1:2
D. ��T2<T1���ﵽƽ��ʱ����������NO���������С��40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������ͭ�ۼ��뵽0.5 L 0.3 mol��L-1 Fe2(SO4)3��0.1 mol��L-1 H2SO4�Ļ����Һ��,ͭ����ȫ�ܽ��,�õ���ҺX������˵����ȷ���� (����)
A. ��ҺX��Cu2+��Fe2+�����ʵ���֮��Ϊ2��1
B. ����ҺX�м�����������,��ַ�Ӧ��,������������11.2 g
C. ����ҺX�еμ�KSCN��Һ,δ���ɫ,�����ͭ������Ϊ12.8 g
D. ����ҺX�м���0.18 L 5 mol��L-1 NaOH��Һ��ʹ��Һ�еĽ���������ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��W��X��Y��Z��ԭ�������������ӡ�p��q��r������ЩԪ����ɵĶ�Ԫ�����m��n�ֱ���Ԫ��Y��Z�ĵ��ʣ�nͨ��Ϊ�����ɫҺ�壬0.01 mol/L r��Һ��pHΪ2��p��Ӣ����ѧ�ҷ����ڳ�Ϊ�������̼����������sͨ����������ˮ����ˮ�ص���״Һ�塣�������ʵ�ת����ϵ��ͼ��ʾ������˵����������

A. q����Һ������
B. W�������ﳣ�³�ѹ��ΪҺ̬
C. p����ʹ���Ը��������Һ��ɫ
D. Z���������ˮ����һ��Ϊǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷Ͼɶ�п��Ƥ���Ʊ�����Fe3O4�������Ӽ�������ZnO���Ʊ�����ͼ����:

��֪:Zn���仯�����������Al���仯������������ơ���ش���������:
��1����NaOH��Һ�����Ͼɶ�п��Ƥ����ȥ�����ۣ�������_____________��
��2��������ҺA��pH�ɲ���Zn(OH)2������Ϊ�Ƶ�ZnO����������������____________�� ϴ�� ��__________________��
��3������ҺB�Ƶ�Fe3O4�������ӵĹ����У������ͨ��N2����ԭ����__________��
��4�����ظ���ط�(һ��������ԭ�ζ���)�ɲⶨ����Fe3O4�еĶ�������������д������������![]() ��
��![]() ��Ӧ�����ӷ���ʽ______��
��Ӧ�����ӷ���ʽ______��![]() ����ԭΪ
����ԭΪ![]() ����
����
��5����������Ũ��Ϊ0.010 00 mol��L-1��K2Cr2O7����Һ250 mL��Ӧȷ��ȡ__________g ��K2Cr2O7(����4λ��Ч��������֪M(K2Cr2O7)=294.0 g��mol-1)�����Ƹñ���Һʱ����������������Ҫ�õ�����_______ (�ñ�ű�ʾ)��
�ٵ�����ƽ ���ձ� ����ƿ ���ܲ����� ��250mL����ƿ ��ͷ�ι� ��������ƽ
��6��������![]() ����Һʱ�����ӿ̶��ߣ���ⶨ���________���ƫ����ƫС�����䡱,��ͬ�����ζ�������,����ζ�ǰװ��K2Cr2O7����Һ�ĵζ��ܼ��첿��������,���ζ�������������ʧ,��ⶨ�����_________ ��
����Һʱ�����ӿ̶��ߣ���ⶨ���________���ƫ����ƫС�����䡱,��ͬ�����ζ�������,����ζ�ǰװ��K2Cr2O7����Һ�ĵζ��ܼ��첿��������,���ζ�������������ʧ,��ⶨ�����_________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �����ӵĽṹʾ��ͼ��![]()
B. 23Na��24Mg���ֺ��ص���������ȣ���˻�Ϊͬλ��
C. CH3COOH�ĵ��뷽��ʽΪ��CH3COOH![]() CH3COO��+H+
CH3COO��+H+
D. 16O��1H��2H��3H���ֺ��ؿɹ���4��ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���鼰�仯�����ڹ�ҵ��������;�㷺��ij�о�С���ø�ѡ���Ļ������Ҫ�ɷ���Bi2S3����������SiO2�����ʣ��Ʊ�NaBiO3�����������£�

��֪��ˮ��������Bi3+��Fe3+��
�ش��������⣺
��1������ȡ��ʱ��Ϊ����߽�ȡ���ʣ��ɲ�ȡ�Ĵ�ʩ��______����дһ����������1����������Ҫ�ɷ���______���ѧʽ����
��2����ȡʱ�������Ũ�����Ŀ����______����ĸҺ����ͨ������X���ѭ�����ã�����XΪ______�������ƣ���
��3��д������ʱ���������ƵĻ�ѧ����ʽ______�������ı�״����4.48 L O2ʱ��ת�Ƶ��ӵ���Ŀ��______��
��4��25��ʱ����Ũ�Ⱦ�Ϊ0.04 mol��L��1��Cu2����Pb2����Bi3���Ļ����Һ�еμ�(NH4)2S��Һ������Һ�������1��������c(Pb2+)=10-5 mol��L-1ʱǡ����ȫ������������Һ��c(Cu2+)��c(Bi3+)��______��[��֪��Ksp(CuS)��6.0��10��36��Ksp(PbS)��3.0��10��28��Ksp(Bi2S3)��1.6��10��20]
��5����˫����(H2Dz����Ԫ���ᣩ��CC14�����ȡ���ɴӹ�ҵ��ˮ����ȡ�������ӣ�H2Dz�Ƚ�����������ϳɵ����Ե�����[��Cu(HDz)2��]������CCl4��ȡ��������ͼ��������������������Hg2+��Bi3+��Zn2+�ķ�ˮʱ��������ߣ�E%��ʾ�����������������ʽ����ȡ����İٷ��ʣ���
�ٵ�����pH��2.5ʱ���飨Bi���Ĵ�����ʽ��______��
������ȡ���CCl4�м���NaOH��Һ�ɽ���Ԫ���������������ʽ������������Ӧ�����ӷ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.01 mol/L�Ĵ�����Һ�У�����1.00 mol/L��pH��7�Ĵ������Һ����ҺpH�����������Һ����仯��ͼ��ʾ�����з�����ȷ����

A. a�㣬pH��2
B. b�㣬c��CH3COO������c��NH![]() ��
��
C. c�㣬pH���ܴ���7
D. ab�Σ�������Һ��ϡ������ҺpH�������Ҫԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pKa=-lgKa��25��ʱ��H2SO3��pKa1=1.85��pKa2=7.19����0.1000molL-1NaOH��Һ�ζ�20.00mL0.1000molL-1H2SO3��Һ�����е�pH�仯��ͼ��ʾ������˵���������
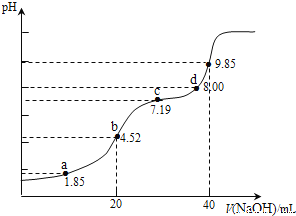
A. a��������Һ�У�3c(H2SO3)+3c(HSO3-)+3c(SO32-)=0.2000molL-1
B. b��������Һ�У�c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c��������Һ�У�c(SO32-)=c(HSO3)
D. d��������Һ�У�c(Na+)��c(SO32-)��c(HSO3-)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com