
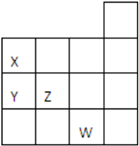
 如图所示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述不正确的是( )
如图所示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述不正确的是( )| A. | 只有④ | B. | ①③④ | C. | ②③ | D. | ①②④ |
分析 根据X、Y、Z、W在元素周期表中的相对位置可知,X为N元素、Y为P元素、Z为S元素、W为Br元素,然后结合元素周期律知识对各选项进行判断.
解答 解:根据元素周期表结构可知,X为N元素、Y为P元素、Z为S元素、W为Br元素,
①Y为P,其最高价氧化物对应的水化物为磷酸,化学式为H3PO4,故①错误;
②Y、Z的非金属性:Z大于Y,非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性Y<Z,故②正确;
③W为Br,其单质为溴,溴单质常温下呈液态,与铁粉反应生成的是FeBr3,故③错误;
④W为Br,原子序数为35,Z为S,原子序数为16,W的原子序数比Z大35-16=19,故④错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容、元素周期表结构为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层 上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Li>Na>K>Rb | B. | 酸性:HF<HCl<HBr<HI | ||
| C. | 微粒半径:K+>Na+>Mg2+>Al3+ | D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥⑦ | B. | ②③④⑤ | C. | ①②④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com