
【题目】硼(B)可形成 H3BO3、NaBH4 、NaBO2等化合物,用途广泛。
(1)H3BO3 为一元弱酸,可由硼砂(Na2B4O7﹒10H2O)与盐酸加热反应制得。该反应的化学方程式为____________________。 常温下 0.1 mol·L-1的H3BO3溶液 pH 约为5.0,则H3BO3的电离常数Ka约为____。
(2)在恒容密闭容器中发生储氢反应:BPO4(s)+4Na(s)+ 2H2(g)![]() Na3PO4(s) + NaBH4(s) ΛH<0
Na3PO4(s) + NaBH4(s) ΛH<0
下图为NaBH4产率与反应温度的关系曲线:
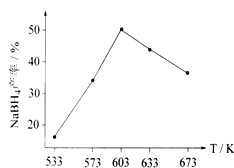
①反应达到平衡时,下列有关叙述正确的是_____。(填标号)
A.生成1mol NaBH4只需1mol BPO4、4mol Na和2 mol H2
B.若向容器内通入少量H2,则v(放氢)< v(吸氢)
C.升高温度,放氢速率加快,重新达到平衡时容器压强增大
D.降低温度,该反应的平衡常数减小
②NaBH4的产率在 603K之前随温度升高而增大的原因是___________________。
(3)NaBH4可水解放出氢气,反应方程式为:NaBH4 + 2H2O=NaBO2 + 4H2↑。
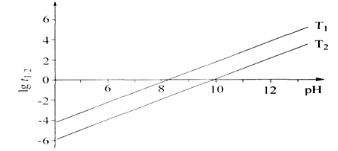
① t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为分钟)。lgt1/2随 pH和温度的变化如图所示。在酸性条件下,NaBH4不能稳定存在,原因是_____(用离子方程式表示);T1__T2。(填“ >” 或“ <”)
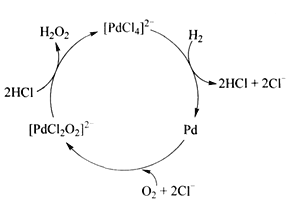
②用H2制备H2O2的一种工艺简单、能耗低的方法, 反应原理如下图所示。总反应的化学方程式为___________。
【答案】Na2B4O7·l0H2O +2HC1![]() 4H3BO3+2NaCl+5H2O 1.0× 10-9 BC 反应未达到平衡状态,温度升高,反应速率加快 BH4- +H++3H2O=H3BO3+4H2↑ < H2+O2
4H3BO3+2NaCl+5H2O 1.0× 10-9 BC 反应未达到平衡状态,温度升高,反应速率加快 BH4- +H++3H2O=H3BO3+4H2↑ < H2+O2 ![]() H2O2
H2O2
【解析】
(1)一元弱酸电离常数为达到平衡时,溶液所电离生成的各种离子浓度的乘积跟溶液中未电离的分子浓度的比。
(2)掌握外界条件温度和浓度对化学平衡移动的影响,即可解题。
(3)温度越低,反应越慢,t1/2越大。根据图示分析出pH相同的时候所对应的lgt1/2越大,t1/2越大。
(1)Na2B4O7﹒10H2O与盐酸加热反应生成H3BO3、NaCl和H2O。因此答案为Na2B4O7·l0H2O +2HC1![]() 4H3BO3+2NaCl+5H2O。H3BO3为一元弱酸,电离方程式为H3BO3
4H3BO3+2NaCl+5H2O。H3BO3为一元弱酸,电离方程式为H3BO3![]() H++H2BO3-,根据电离常数的定义可知Ka=
H++H2BO3-,根据电离常数的定义可知Ka=![]() =
=![]() =1.0×10-9。
=1.0×10-9。
(2)①A.该反应为可逆反应,1mol BPO4、4mol Na和2 mol H2不可能完全反应转化为1mol NaBH4,故A错误。
B.若向容器内通入少量H2,增加反应物的浓度,反应向正反应方向进行,则v(放氢)< v(吸氢)。故B正确。
C.升高温度,正逆反应速率都加快,升高温度反应向吸热反应即放氢方向进行,重新达到平衡时容器压强增大,故C正确。
D.该反应为放热反应,温度降低,平衡向正反应方向进行,平衡常数变大,故D错误。本题选BC。
②NaBH4的产率在 603K之前随温度升高而增大是因为反应没有达到平衡状态,温度升高,反应速率加快。
(3)①根据NaBH4水解的化学方程式可知BH4-中H显-1价,和水电离的H+发生氧化还原反应生成H2。在酸性条件下BH4-和H+发生氧化还原反应生成H2,离子方程式为BH4- +H++3H2O=H3BO3+4H2↑。t1/2越大lg t1/2越大,pH相同的时候T1对应的lg t1/2大,也就是T1时水解的半衰期长,反应速率慢,温度低,T1<T2。
②根据图示可知Pd和[PdCl2O2]2-为中间产物,[PdCl4]2-为催化剂,反应的化学方程式为H2+O2![]() H2O2。
H2O2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关能量的判断和表示方法正确的是
A.由C(s,石墨)=C(s,金刚石) H=+1.9 kJ/mol,可知:石墨比金刚石更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq) =H2O(l) H=-57.3 kJ/mol,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ
D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g) =2H2O(l) H=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在自然界中以游离态和多种化合态形式出现,硫的化合物大多具有氧化性或还原性,许多金属硫化物难溶于水。完成下列填空:
(1)SO2能使KMnO4溶液褪色,还原产物是MnSO4,写出该反应的化学方程式__________。
(2)将SO2通入BaCl2溶液至饱和,未见沉淀生成,滴加溴水后,出现白色沉淀,该白色沉淀化学式为________。
(3)向Na2S固体中分别加入浓硫酸和稀硫酸,所得产物__________(填“相同”或“不同”),由此可知硫酸氧化性的强弱与__________有关。
(4)已知NaHSO3溶液显酸性,溶液中离子浓度由大到小的顺序是_____________。
(5)为了使Na2S溶液中c(Na+)/c(S2)的比值变小,可适量加入(或通入)的物质是___________
a.H2S气体 b.NaOH固体 c.HCl气体 d.KOH固体
(6)在图中,从A管通入一定量SO2后,在B处检测到有新的气体生成。B处排出的气体中(填“含”或“不含”)___________H2S。(已知:酸性H2SO4>H2CO3≈H2S)
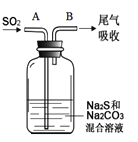
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制取无水A1C13(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是
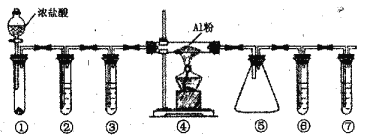
A. ①的试管中盛装二氧化锰,用于常温下制备氯气
B. ②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C. 滴加浓盐酸的同时点燃④的酒精灯
D. ⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
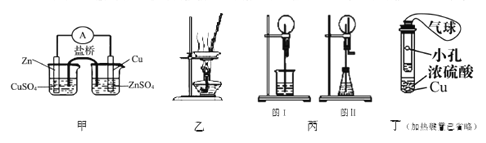
A. 甲装置构成铜锌原电池
B. 用图乙所示装量加热AlCl3饱和溶液然后利用余热蒸干制备AlCl3固体
C. 丙装置里图I烧瓶中充满氨气,烧杯中盛装水,在图II的锥形瓶中,加入足量的Cu与稀硝酸,图I和图II都产生喷泉现象且原理相同
D. 利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验:
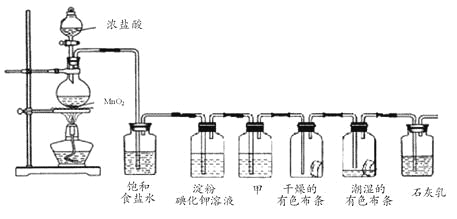
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是________________,反应的离子方程式为_____________。
(2)若干燥的有色布条不褪色,潮湿的有色布条褪色,则甲中盛放________(填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为___________________________。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)关注营养平衡,促进身心健康。从下列四种物质中选择相应字母代号回答下列问题:
A 靑霉素 B 水 C 酱油 D 纤维素
①为最重要的抗生素,属于消炎药的是____;
②能刺激肠道蠕动,有助于食物消化的是___;
③为促进铁的吸收,我国选择作为铁强化食物的载体是___;
④属于人体的重要组成成分,每人每天要补充2.5~4.0L的是___。
(2)探索材料,丰富生活。请回答下列问题:
①家用菜刀的主要材质是用____;
A 铁合金 B 铝合金
②汽车轮胎的主要成分是___;
A 合成纤维 B 合成橡胶
③传统硅酸盐产品主要指____、陶瓷和水泥。
(3)保护生存环境,我们都在行动。请回答下列问题:
①正常雨水偏酸性,pH约为___;
②利用沉淀反应是除去水中重金属离子的常用方法。例如,向含Hg2+的废水中加入Na2S,可以使Hg2+转化为沉淀而除去。该反应的离子方程式为_____;
③我国《城市生活垃圾分类标志》中,代表回收标志的是_____;
A  B
B 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有0.6molCl-、0.8 molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则
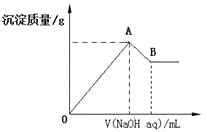
A.x=![]()
B.x的取值范围是0<x<11/32
C.A点横坐标的值随x发生变化
D.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com