
| A. | 原子半径:Y>Z>W | B. | 酸性:HWO4>HXO3>H3YO4 | ||
| C. | 热稳定性:HW>XH3>YH3 | D. | 离子半径:Y3-<Z2-<W- |
分析 由元素在周期表的位置可知,X为N,Y为P,Z为S,W为Cl,
A.同周期从左向右原子半径减小;
B.非金属性Cl>N>P,非金属性越强,对应最高价含氧酸的酸性越强;
C.非金属性越强,对应氢化物越稳定;
D.具有相同电子排布的离子中,原子序数大的离子半径小.
解答 解:由元素在周期表的位置可知,X为N,Y为P,Z为S,W为Cl,
A.同周期从左向右原子半径减小,则原子半径:Y>Z>W,故A正确;
B.非金属性Cl>N>P,酸性:HWO4>HXO3>H3YO4,故B正确;
C.非金属性越强,对应氢化物越稳定,则热稳定性:HW>XH3>YH3,故C正确;
D.具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:Y3->Z2->W-,故D错误;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
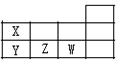
| X | Z | |
| Y | W |
| A. | X是第ⅢA元素,Z是第ⅤA元素 | |
| B. | 原子半径大小关系:r(Y)<r(W) | |
| C. | Y的气态氢化物比Z的气态氢化物稳定 | |
| D. | X、Y、W三种元素的最高化合价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 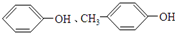 | B. | 甲苯和C3H8O3 | ||
| C. | CH4、C2H4O2 | D. | C3H4、C3H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的负极发生还原反应 | |
| B. | 电化学反应的实质是金属单质失去电子形成阳离子,而电子直接给氧化剂 | |
| C. | 金属在潮湿环境中主要发生析氢腐蚀 | |
| D. | 铜铁在潮湿的中性环境中锈蚀时,开始有Fe(OH)2,而后逐渐变成Fe(OH)3和Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2的结构式:O=C=O | B. | CH4的球棍模型: | ||
| C. | H2O的电子式: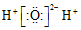 | D. | C2H4的结构简式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
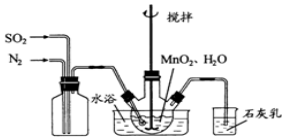
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com