
| A. | C3H8 | B. | C3H7Cl | C. | CH2Cl2 | D. | C2H6O |
分析 A.含有4个碳原子或大于4个碳原子的烷烃,存在同分异构体;
B.C3H7Cl是C3H8的一氯取代产物,根据C3H8中等效H原子判断;
C.CH2Cl2是甲烷的二氯取代产物,根据甲烷的空间结构判断;
D.醇和醚类之间存在类别异构.
解答 解:A.C3H8为丙烷,不存在同分异构体,故A错误;
B.C3H7Cl是C3H8的一氯取代产物,C3H8中有2种H原子,所以C3H8的一氯取代产物有2种同分异构体,故B正确;
C.CH2Cl2是甲烷的二氯取代产物,甲烷正四面体结构,CH2Cl2不存在同分异构体,故C错误;
D.C2H6O存在乙醇,甲醚2种同分异构体,故D正确
故选:BD.
点评 本题考查同分异构体书写知识,难度较小,旨在考查学生对基础知识的理解与掌握.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只含有离子键 | |
| B. | 共价化合物中可能含离子键 | |
| C. | 含离子键的化合物不一定为离子化合物 | |
| D. | 共价化合物中不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐减小 | B. | 最高正化合价逐渐增大 | ||
| C. | 电子层数逐渐增多 | D. | 元素的非金属性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 能量转化形式 |
| ①CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | 由 化学能转化为 热能 |
| ②Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | 由 化学能转化为 电能 |
| ③CaCO3$\frac{\underline{\;高温\;}}{\;}$Ca+CO2↑ | 由 热能转化为 化学能 |
| ④6nH2O+6nCO2$→_{叶绿素}^{光}$(C6H12O6)n+6nO2 | 由 光能转化为 化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W:位于元素周期表中的第三周期,ⅢA族 | |
| B. | 元素X:它的原子中M层比L层少2个电子 | |
| C. | 元素Y:它的焰色反应颜色呈黄色 | |
| D. | 元素Z:它的二价阳离子核外电子总数与氩原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
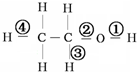
| A. | 与钠反应① | B. | 在铜催化下加热①③ | ||
| C. | 在浓硫酸170°C条件下加热②③ | D. | 与HCl反应生成氯乙烷② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
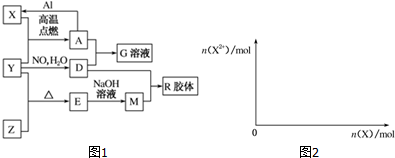
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

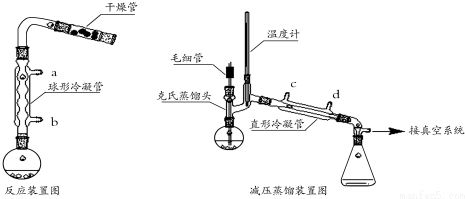
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com