
【题目】下列溶液中氯离子浓度与50mL1mol·L-1的AlCl3溶液中氯离子浓度相等的是 ( )
A.150mL1mol·L-1的NaCl B.150mL3mol·L-1的KCl
C.75mL2 mol·L-1的CaCl2 D.75mL2mol·L-1的NH4Cl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)![]() 2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
A.3 B.5 C.6 D.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下,硅单质和HCl反应生成SiHCl3是粗硅提纯的重要步骤。某小组设计如图所示装置完成上述转化(夹持装置略去)。
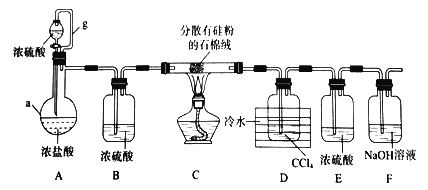
已知:SiHCl3的沸点为33.0°C,易溶于有机溶剂,能与水剧烈反应,在空气中易被氧化,CCl4的沸点为76.8°C。请回答:
(1)仪器a的名称为 ;导管g的作用为 ;
(2)装置A中,浓硫酸体现的性质为 ;实验时,需先打开分液漏斗活塞,一段时间后,在点燃C处酒精灯,理由是 ;
(3)装置C中发生反应的化学方程式为 ;
(4)装置D中所得的液态混合物的分离方法为 。(填操作名称)
(5)反应后的气体通过装置F中的NaOH溶液后,对逸出气体的处理方法为 ;
(6)SiHCl3在潮湿的空气中被氧化,生成一种氧化物和一种无氧酸,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国三峡工程所提供的清洁、廉价、可再生的水电,相当于每年燃烧 3000 万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制 ①温室效应 ②SO2的排放 ③白色污染 ④臭氧空洞( )
A.①② B.①②③ C.①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. ![]() 的溶液中:Na+、K+、SiO32—、SO32-
的溶液中:Na+、K+、SiO32—、SO32-
B. pH=1的溶液中:K+、Al3+、SO42-、F—
C. 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl-
D. 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。第三代太阳能电池就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池及薄膜Si系太阳能电池。
(1)现代化学中,常利用 上的特征谱线来鉴定元素
(2)铟是镓的同主族的相邻元素,它位于元素周期表的 区,它的价电子排布式是 。
(3)硒为第4周期氧族元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 。(用元素符号表示)
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有特殊的性质。如BF3与一定量水能形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及 (填序号)
A离子键 B共价键 C配位键 D金属键 e氢键 f范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化

(5)一种铜金合金晶体如图所示(Au原子位于顶点,Cu原子位于面心),则该合金中Au原子与Cu原子个数之比为__________,若该晶胞的边长为a pm,则合金的密度为___________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

(1)该条件下反应平衡常数表达式K=______________;在t1 ℃时,反应的平衡常数为____________,达到平衡时n(CH3OCH3):n(CH3OH):n(H2O)=_____________________。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为:c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4mol·L-1,此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”),反应向__________反应方向进行(填“正”或“逆”).。
Ⅱ.已知可逆反应:M(g)+N(g) ![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
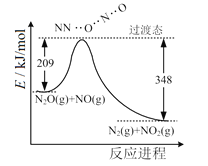
A.反应生成1mol N2时转移4 mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g) = N2(g)+NO2(g) △H=-139kJ/mol
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com