
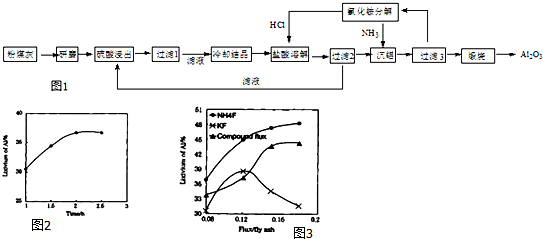
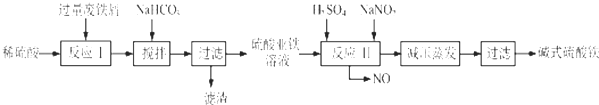
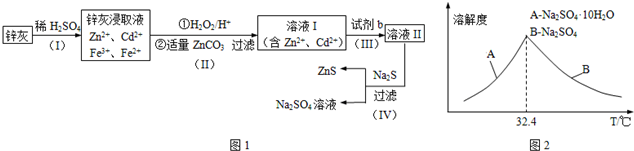
分析 粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等,加入硫酸溶液使Al2O3溶解,CaO通过反应生成CaSO4,CaSO4微溶,大部分CaSO4和SiO2一起成为滤渣,过滤后将滤液冷却结晶得Al2(SO4)3,用盐酸溶解Al2(SO4)3,再通入氯化氢得AlCl3•6H2O晶体和硫酸溶液,过滤得硫酸溶液可以再循环利用,AlCl3•6H2O晶体溶解后得氯化铝溶液中通入氨气得氢氧化铝沉淀和氯化铵溶液,氯化铵溶液可以循环利用,氢氧化铝沉淀受热分解生成Al2O3,以此解答该题.
解答 解:(1)粉煤灰研磨的目的是增大反应物的接触面积,提高浸取速率和浸出率,
故答案为:增大反应物的接触面积,提高浸取速率和浸出率;
(2)通过上面的分析可知,第1次过滤时滤渣的主要成分有SiO2和 CaSO4,第3次过滤时滤渣的成分是Al(OH)3,
故答案为:SiO2; CaSO4;Al(OH)3;
(3)根据图1可知,2h时铝的浸出率达到最大值,所以适宜的浸取时间为2h,根据图2可知,在$\frac{n(助溶剂)}{n(粉煤灰)}$相同时,NH4F助溶剂对铝的浸出率最高,用含氟的化合物作这种助溶剂的缺点是生产过程中会产生污染环境的HF和NH3等,
故答案为:2; NH4F;生产过程中会产生污染环境的HF和NH3等;
(4)根据上面的分析可知,流程中循环使用的物质有H2SO4和NH4Cl,
故答案为:H2SO4;NH4Cl;
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C13•6H20,该过程能够发生的原因是通入氯化氢使A1C13•6H20达到饱和,而硫酸铝不饱和,便于A1C13•6H20析出,
故答案为:通入氯化氢使A1C13•6H20达到饱和,而硫酸铝不饱和;
(6)用粉煤灰制取含铝化合物的主要意义在于使废弃固体资源化利用,
故答案为:使废弃固体资源化利用.
点评 本题以教材重要基本理论和原理为知识平台综合考查化学反应基本原理、物质的性质等在化学与技术中的综合应用,为高考常见题型,侧重于学生的分析能力和实验能力的考查,解题关键在于找准中间产品和相互交叉的流水生产线,在分析过程中,抓住中间产品的关联作用,逐一破解,难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
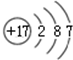 ②
②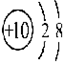 ③
③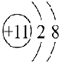 ④
④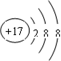
| A. | ①②两种粒子所属的元素在元素周期表的同一横行 | |
| B. | ②③④对应的元素化学性质相似 | |
| C. | ①③对应的元素是同一周期元素 | |
| D. | ③④可形成X2Y型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
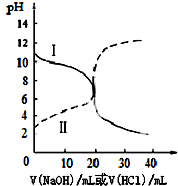 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时溶液的pH=5则:c(H+)-c((NH3•H2O)=c(OH-)=1×10-9 mol•L-1 | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com