
分析 (1)X原子有两个电子层,它能与最活泼的金属Y形成Y3X的化合物,Y为+1价,则X为-3价,位于第VA族;
(2)若某元素原子的电子层数和Na原子的相同,有3个电子层,最外层电子数与F原子相同,则其最外层电子数为7,元素的原子序数=原子核外电子数.
解答 解:(1)X原子有两个电子层,它能与最活泼的金属Y形成Y3X的化合物,Y为+1价,则X为-3价,其最外层有5个电子,位于第VA族,且位于第二周期,为N元素,故答案为:N;
(2)若某元素原子的电子层数和Na原子的相同,有3个电子层,最外层电子数与F原子相同,则其最外层电子数为7,其原子核外电子数=2+8+7=17,元素的原子序数=原子核外电子数=17,故答案为:17.
点评 本题考查原子结构和元素性质,为高频考点,明确原子结构、元素周期表结构是解本题关键,侧重考查学生对周期表结构的掌握,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 3:1 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医学上,血液透析是利用了胶体的渗析原理 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

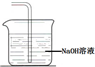 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
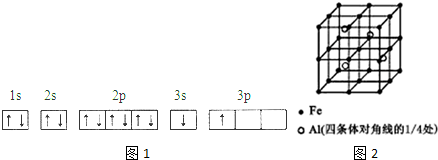
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com