
某同学用如图所示的装置来探究SO2的性质。
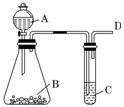
(1)实验前首先应做的操作是_________________________________________________。
(2)实验室用亚硫酸钠固体与较浓硫酸反应制取SO2气体,写出该反应的化学方程式:________________________________________________________________________。
(3)分别将SO2气体通入下列C溶液中,请回答下列问题:
 ①若C为紫色石蕊试液:
①若C为紫色石蕊试液:
| 操作 | 现象 |
| 通入少量SO2 | |
| 继续通入过量SO2 |
②若C为品红溶液:
| 操作 | 现象 |
| 通入足量SO2 | |
| 将试管加热 |
③若C为酸性KMnO4溶液,通入足量SO2,现象______________,KMnO4被________。
④若C为澄清石灰水,通入足量SO2,现象__________________,发生反应的离子方程式________________________________________________________________________
________________________________________________________________________。
解析:(1)实验前应先检查装置的气密性。
(2)Na2SO3固体与较浓硫酸反应制取SO2气体遵循强酸制弱酸的原理。
(3)①SO2只能使紫色石蕊试液变红,而不能使其褪色。
②SO2具有漂白性,能与品红溶液生成无色物质而使其颜色褪去,但无色物质性质不稳定,加热后又会恢复原来颜色。
③SO2有较强的还原性,酸性KMnO4有较强的氧化性,两者反应使紫色褪去。
④SO2与碱溶液反应,因量的不同产物不同,现象也不同。开始SO2的量少,发生SO2+Ca(OH)2===CaSO3↓+H2O,后来SO2量增加至过量,白色沉淀又溶解。
答案:(1)检查装置的气密性
(2)Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
(3)①紫色溶液变红色 红色不褪去(或溶液颜色无变化) ②品红溶液颜色褪去 品红溶液恢复原来颜色 ③溶液褪色 还原 ④首先有白色沉淀生成,然后白色沉淀消失 SO2+Ca2++2OH-===CaSO3↓+H2O,CaSO3+SO2+H2O===Ca2++2HSO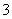


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
一定条件下将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应N2+3H2 2NH3。下列关于该反应的说法正确的是( )
2NH3。下列关于该反应的说法正确的是( )
A.最终可生成0.2 mol NH3 B.使用催化剂不影响反应速率
C.增大压强反应速率减小 D.升高温度反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)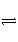
 CH3OH(g) 正向为放热反应,第2 min时只改变一个条件,反应情况如下表:
CH3OH(g) 正向为放热反应,第2 min时只改变一个条件,反应情况如下表:
| 时间 | c(CO)/mol·L-1 | C(H2)/mol·L-1 | c(CH3OH)/mol·L-1 |
| 起始 | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.2 |
| 第4 min | 0.4 | 1.8 | 0.6 |
| 第6 min | 0.4 | 1.8 | 0.6 |
下列说法不正确的是( )
A.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
B.第4 min至第6 min该化学反应处于平衡状态
C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D.第6 min时,其他条件不变,如果升高温度,正逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.硫单质常存在于火山喷口附近
B.进行SO2性质探究实验时,多余的SO2应排到实验室外
C.SO2气体通入BaCl2溶液中不能产生白色沉淀
D.硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或事实不能用同一原理解释的是( )
A.SO2和Na2SO3溶液都能使溴水褪色
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.Cl2和SO2都能使品红溶液褪色
D.浓硝酸和氯水用棕色试剂瓶保存
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示某固态单质 A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式_______________________________
________________________________________________________________________。
(2)写出E与A的氢化物反应生成A的化学方程式_______________________。
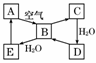
(3)写出一个D生成B的化学方程式____________________________________________
________________________________________________________________________;
(4)将5 mL 0.10 mol/L的E溶液与10 mL 0.10 mol/L的NaOH溶液混合。
①写出反应的离子方程式:___________________________________________;
②反应后溶液的pH________7(填“大于”、“小于”或“等于”),理由是________________________________________________________________________
________________________________________________________________________。
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减少”),理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2-氨基-5硝基苯甲醚俗称红色基B,主要用于绵纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式为: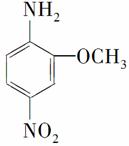 ,若分子式与红色基B相同,且氨基(—NH2)与硝基(—NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能有( )
,若分子式与红色基B相同,且氨基(—NH2)与硝基(—NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能有( )
A.2种 B.4种
C.6种 D.10种
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B两种常见化合物组成的混合物,其焰色反应均为黄色,其相互转化关系如图(其他物质均略去)。

根据以上关系,回答下列问题:
(1)写出A、B、C、D的化学式:A________,B_____ ___,
___,
C____________,D____________。
(2)写出混合物中加水反应的化学方程式:_________________________________。
(3)加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为____________(填数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com