
ŌŚFeCl3ČÜŅŗŹ“æĢĶ²ÖĘŌģµēĀ·°åµÄ¹¤ŅÕÖŠ£¬·ĻŅŗ“¦ĄķŗĶ׏Ō“»ŲŹÕµÄ¹ż³Ģ¼ņŹöČēĻĀ£ŗ
¢ń£ŗĻņ·ĻŅŗÖŠĶ¶Čė¹żĮæĢśŠ¼£¬³ä·Ö·“Ó¦ŗó·ÖĄė³ö¹ĢĢåŗĶĀĖŅŗ£»
¢ņ£ŗĻņĀĖŅŗÖŠ¼ÓČėŅ»¶ØĮæŹÆ»ŅĖ®£¬µ÷½ŚČÜŅŗpH£¬Ķ¬Ź±¹ÄČė×ćĮæµÄæÕĘų”£
ŅŃÖŖ£ŗKsp[Fe(OH)3]£½4.0”Į10£38
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©FeCl3Ź“æĢĶ²·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £»
£Ø2£©¹ż³Ģ¢ń¼ÓČėĢśŠ¼µÄÖ÷ŅŖ×÷ÓĆŹĒ £¬·ÖĄėµĆµ½¹ĢĢåµÄÖ÷ŅŖ³É·ÖŹĒ £¬“Ó¹ĢĢåÖŠ·ÖĄė³öĶŠč²ÉÓƵķ½·ØŹĒ £»
£Ø3£©¹ż³Ģ¢ņÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £»
£»
£Ø4£©¹ż³Ģ¢ņÖŠµ÷½ŚČÜŅŗµÄpHĪŖ5£¬½šŹōĄė×ÓÅضČĪŖ ”£
”¾ÖŖŹ¶µć”æĢś¼°Ęä»ÆŗĻĪļµÄŠŌÖŹ ČܶȻżµÄ¼ĘĖć C3 H5
”¾“š°ø½āĪö”æ (µŚ(3) Š”ĢāĆææÕ 1·Ö£¬ĘäÓąĆææÕ2·Ö£¬±¾Ģā¹²12·Ö)
£Ø1£©2Fe3£«£«Cu£½2Fe2£«£«Cu2£«
£Ø2£©»ŲŹÕĶ£» CuŗĶFe£» ¼ÓŃĪĖį·“Ó¦ŗó¹żĀĖ
£Ø3£©FeCl2£«Ca(OH)2£½Fe(OH)2”ż£«CaCl2 £» 4Fe(OH)2£«O2£«2H2O£½4Fe(OH)3
£Ø4£©4.0”Į10£11 mol·L£1
½āĪö£ŗ£Ø1£©ĄūÓĆŃõ»Æ»¹Ō·“Ó¦¹ęĀÉ£ŗ2Fe3£«£«Cu£½2Fe2£«£«Cu2£«
£Ø2£©Ļņ·ĻŅŗÖŠĶ¶Čė¹żĮæĢśŠ¼£¬Ģś»įŗĶČżĀČ»ÆĢśČÜŅŗ·“Ӧɜ³ÉĀČ»ÆŃĒĢś£¬ŗĶĀČ»ÆĶ·“Ӧɜ³ÉĶŗĶĀČ»ÆŃĒĢś£¬ĖłŅŌ¼ÓČėĢś·ŪŹĒĪŖĮĖµĆµ½Ķ£¬¹żĀĖµĆµ½¹ĢĢåŹĒ¹żĮæµÄĢśŗĶĶ£¬ÓĆŃĪĖįČܽāĢś·“Ó¦£¬Ķ²»·“Ó¦¹żĀĖµĆµ½Ķ£»
£Ø3£©ĀĖŅŗ³É·ÖĪŖĀČ»ÆŃĒĢśČÜŅŗ£¬¼ÓČėŹÆ»ŅĖ®·“Ӧɜ³ÉĒāŃõ»ÆŃĒĢś³Įµķ£¬ŌŚæÕĘųÖŠŃøĖŁŃõ»ÆĪŖĒāŃõ»ÆĢś£»·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗFeCl2+Ca£ØOH£©2=Fe£ØOH£©2”ż+CaCl2”¢4Fe£ØOH£©2+O2+2H2O=4Fe£ØOH£©3£»
£Ø4£©¹ż³Ģ¢ņÖŠµ÷½ŚČÜŅŗµÄpHĪŖ5£¬³£ĪĀĻĀČÜŅŗÖŠĒāŃõøłĄė×ÓÅضČĪŖ10-9mol/L£¬ŅĄ¾ŻČܶȻż³£Źż¼ĘĖćĢśĄė×ÓÅØ¶Č£¬Fe£ØOH£©3£Øs£©⇌Fe3++3OH-£¬Ksp=C(Fe3+)”ĮC3(OH-), C(Fe3+)=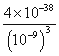 =4.0”Į10£11 mol·L£1
=4.0”Į10£11 mol·L£1
”¾Ė¼Ā·µć²¦”æ±¾Ģāæ¼²éĢśĄė×ÓµÄŃõ»ÆŠŌ£¬ĒāŃõ»ÆĢśĒāŃõ»ÆŃĒĢśµÄ×Ŗ»Æ·“Ó¦£¬ČܶȻżµÄ¼ĘĖć£¬±Č½Ļ»ł“””£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
·ÖĄė±½ŗĶ±½·ÓµÄ»ģŗĻĪļ£¬Ķس£²ÉÓƵķ½·ØŹĒ(””””)
A£®Õńµ“»ģŗĻĪļ£¬ÓĆ·ÖŅŗĀ©¶··ÖĄė
B£®¼ÓČėNaOHČÜŅŗŗóÕńµ“£¬ÓĆ·ÖŅŗĀ©¶··ÖĄė£»Č”ĻĀ²ćŅŗĢåĶØČėCO2£¬“ż·Ö²ćŗó·ÖŅŗ
C£®¼ÓĖ®Õńµ“ŗóÓĆ·ÖŅŗĀ©¶··ÖĄė
D£®¼ÓĻ”ŃĪĖįÕńµ“ŗó£¬ÓĆ·ÖŅŗĀ©¶··ÖĄė
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
FeCl3”¢ CuCl2µÄ»ģŗĻČÜŅŗÖŠ¼ÓČėĢś·Ū£¬³ä·Ö·“Ó¦ŗóČŌÓŠ¹ĢĢå“ęŌŚ£¬ĻĀĮŠÅŠ¶Ļ²»ÕżČ·µÄŹĒ
A.¼ÓČĖKSCNČÜŅŗŅ»¶Ø²»±äŗģÉ« B.ČÜŅŗÖŠŅ»¶Øŗ¬Fe2+
C.ČÜŅŗÖŠŅ»¶Ø²»ŗ¬Cu2+ D.Ź£Óą¹ĢĢåÖŠŅ»¶Øŗ¬Cu
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻÖÓŠFeSO4”¢Fe2£ØSO4£©3”¢H2SO4µÄ»ģŗĻČÜŅŗ£¬ĘäÖŠc£ØH+£©=0.10mol/L£®Č”øĆČÜŅŗ200mL£¬¼ÓČė¹żĮæBaCl2ČÜŅŗ£¬³ä·Ö·“Ó¦ŗó¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬µĆµ½³Įµķ27.96g£»ŌŁĮķČ”øĆ»ģŗĻČÜŅŗ200mL£¬ĻņĘäÖŠ¼ÓČė¹żĮæNaOHČÜŅŗ£¬½Į°čŹ¹Ęä³ä·Ö·“Ó¦£¬“ż³ĮµķČ«²æ±äĪŖŗģŗÖÉ«ŗ󣬹żĀĖ”¢Ļ“µÓ²¢×ĘÉÕĖłµĆ¹ĢĢ壬×īÖÕµĆ¹ĢĢå8.00g£®ŌņŌ»ģŗĻČÜŅŗÖŠc£ØFe2+£©Óėc£ØFe3+£©Ö®±ČĪŖ£Ø””””£©
A£®4£ŗ1 B£®3£ŗ1 C£®2£ŗ1 D£®1£ŗ1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¼ÓČėŹŹĮæKSCNČÜŅŗŗ󣬱ä³ÉŃŖŗģÉ«µÄŹĒ
A£®AlCl3ČÜŅŗ”” ””B£®FeCl3ČÜŅŗ””””””C£®NaClČÜŅŗ”” ””D. Cu(NO3)2ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖAĪŖµ»ĘÉ«¹ĢĢ壬T”¢RĪŖĮ½ÖÖ³£¼ūµÄÓĆĶ¾ŗܹćµÄ½šŹōµ„ÖŹ£¬DŹĒ¾ßÓŠ“ÅŠŌµÄŗŚÉ«¾§Ģ壬 CŹĒĪŽÉ«ĪŽĪ¶µÄĘųĢ壬HŹĒ°×É«³Įµķ£¬ĒŅŌŚ³±ŹŖæÕĘųÖŠŃøĖŁ±äĪŖ»ŅĀĢÉ«£¬×īÖÕ±äĪŖŗģŗÖÉ«¹ĢĢ唣

£Ø1£©Š“³öĻĀĮŠĪļÖŹµÄ»ÆѧŹ½£ŗ
A£ŗ D£ŗ R£ŗ ”£
£Ø2£©°“ŅŖĒóŠ“ĻĀĮŠ·“Ó¦·½³ĢŹ½£ŗ
HŌŚ³±ŹŖæÕĘųÖŠ±ä³ÉMµÄ¹ż³ĢÖŠµÄ»Æѧ·½³ĢŹ½£ŗ £»
ĻņNÖŠĶØ×ćĮæCO2Ź±·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ £»
DÓėŃĪĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£
£Ø3£©¼ņŹö¼ģŃéĘųĢåCµÄ·½·Ø£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
£®ÓŠŅ»ÖÖ°×É«·ŪÄ©ÓɵČÖŹĮæµÄĮ½ÖÖĪļÖŹ»ģŗĻ¶ų³É£¬·Ö±šČ”ŹŹĮæøĆ°×É«·ŪÄ©ÖĆÓŚČżÖ§ŹŌ¹ÜÖŠ½ųŠŠŹµŃ锣£Ø1£©ÖšµĪ¼ÓČė6mol·L-1ŃĪĖį£¬Ķ¬Ź±²»¶ĻÕńµ“ŹŌ¹Ü£¬ÓŠĘųÅŻ²śÉś£¬·“Ó¦½įŹųŗóµĆµ½ĪŽÉ«ĶøĆ÷ČÜŅŗ£Ø2£©¼ÓČČŹŌ¹ÜÖŠµÄ°×É«·ŪÄ©£¬ŹŌ¹ÜæŚÓŠĖ®µĪÄż½į£Ø3£©ÖšµĪ¼ÓČė6mol·L-1ĮņĖį£¬Ķ¬Ź±²»¶ĻÕńµ“ŹŌ¹Ü£¬ÓŠĘųÅŻ²śÉś£¬·“Ó¦½įŹųŗóŹŌ¹ÜÖŠ»¹ÓŠ°×É«²»ČÜĪļ”£ĻĀĮŠ»ģŗĻĪļÖŠ·ūŗĻŅŌÉĻŹµŃéĻÖĻóµÄŹĒ£Ø £©
A£®NaHCO3”¢AgNO3 B£®BaCl2”¢MgCO3 C£®NH4HCO3”¢MgCl2 D£®CaCl2·6H2O”¢Na2CO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĆĄ¹śæĘѧ¼Ņ½«Ē¦ŗĶė“Į½ÖÖŌŖĖŲµÄŌ×ÓŗĖ¶Ōײ,»ńµĆĮĖŅ»ÖÖÖŹ×ÓŹżĪŖ118”¢ÖŹĮæŹżĪŖ293µÄŠĀŌŖĖŲ,øĆŌŖĖŲŌ×ÓŗĖÄŚµÄÖŠ×ÓŹżŗĶŗĖĶāµē×ÓŹżÖ®²īĪŖ””(””””)
A.47”””””””” B.175”””””” ”” C.61”””””” ””D.57
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŃŠ¾æ·¢ĻÖ£¬æÉŅŌÓĆŹÆÄ«×÷Ńō¼«”¢īŃĶų×÷Ņõ¼«”¢ČŪČŚCaF2©CaO×÷µē½āÖŹ£¬ĄūÓĆĶ¼Ź¾×°ÖĆ»ńµĆ½šŹōøĘ£¬²¢ŅŌøĘĪŖ»¹Ō¼Į»¹Ō¶žŃõ»ÆīŃÖʱø½šŹōīŃ£®ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø””””£©
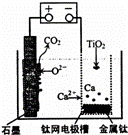
| ”” | A£® | ½«ČŪČŚCaF2©CaO»»³ÉCa£ØNO3£©2ČÜŅŗŅ²æÉŅŌ“ļµ½ĻąĶ¬ÄæµÄ |
| ”” | B£® | Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗC+2O2©©4e©ØTCO2”ü |
| ”” | C£® | ŌŚÖʱø½šŹōīŃĒ°ŗó£¬ÕūĢ××°ÖĆÖŠCaOµÄ×ÜĮæ¼õÉŁ |
| ”” | D£® | ČōÓĆĒ¦Šīµē³Ų×÷øĆ×°ÖĆµÄ¹©µēµēŌ“£¬”°+”±½ÓĻßÖłÓ¦Į¬½ÓPbµē¼« |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com