
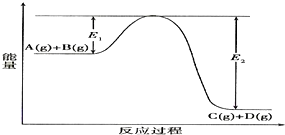
分析 (1)反应物的总能量高于生成物的总能量为放热反应,反应物的总能量低于生成物的总能量为吸热反应;
(2)依据温度对平衡移动的影响分析解答:升高温度平衡向吸热方向移动.
解答 解:(1)由反应过程中的能量变化图可知:A(g)+B(g)?C(g)+D(g)过程中,反应物的总能量高于生成物的总能量为放热反应;
故答案为:放热;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,所以A的转化率减小;
故答案为:减小;该反应正反应为放热反应,升高温度使平衡向逆反应方向移动.
点评 本题通过图象分析反应放热还是吸热与反应物生成物能量高低的关系,考查了化学平衡的影响因素等,熟悉吸热、放热反应特点、明确温度对平衡移动的影响是解题关键,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
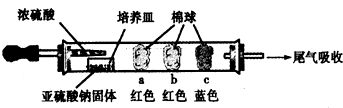
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精的浓度通常为95% | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 将水坝的钢铁闸门与直流电的正极相连可以防闸门腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol•L-1NaClO溶液中阴离子总数大于0.1NA | |
| B. | 7.8gNa2O2中含有的阴、阳离子总数是0.3NA | |
| C. | N2H2分子中各原子的最外层(除H外)均为8电子结构,1molN2H2中有共用电子对数目为3NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜反应,转移电子数小于0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
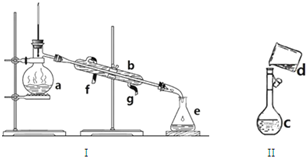
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
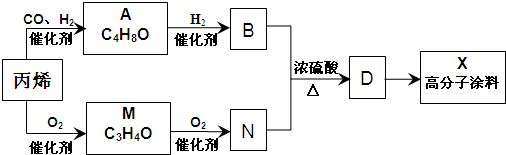
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
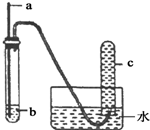 用下图所示装置进行实验,实验现象对应的结论正确的是( )
用下图所示装置进行实验,实验现象对应的结论正确的是( )| a | b | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | c中收集到大量无色气体 | 稀硝酸与铜反应生成NO2 |
| B | 木条 | 18.4mol/L浓硫酸 | 木条变黑 | 浓硫酸具有酸性 |
| C | 铁钉 | 饱和食盐水 | 部分水进入导管 | 铁钉发生吸氧腐蚀 |
| D | 铝片 | 浓硝酸 | 无明显现象 | 铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com