
【题目】下图是合成有机高分子材料W的流程图:

已知: 
回答下列问题:(1)B的结构简式:____ ____
(2)E中所含官能团的结构简式:
(3)B→C反应类型为_ _____ __
(4)写出下列反应的化学方程式:
D+E→W:___________ __
C与银氨溶液反应:___________ ___
(5)满足以下条件的E的同分异构体有 种
① 可发生银镜反应 ② 可与NaHCO3溶液生成CO2 ③能与FeCl3溶液反应显紫色
【答案】(1)CH2=CHCHO;(2)-COOH;(3)加成反应;
(4)![]() ;
;
HOCH2CH2CHO+2Ag(NH3)2OH![]() HOCH2CH2COONH4+2Ag↓+3NH3↑+3H2O;(5)10。
HOCH2CH2COONH4+2Ag↓+3NH3↑+3H2O;(5)10。
【解析】
试题分析:丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,CH2=CHCH2Cl在氢氧化钠水溶液、加热条件下发生水解反应生成A为CH2=CHCH2OH,A发生氧化反应生成B为CH2=CHCHO,根据信息可知B与水在过氧化物条件下发生加成反应生成C为HOCH2CH2CHO,C与氢气发生加成反应生成D为HOCH2CH2CH2OH.对二甲苯发生氧化反应生成E为![]() ,D与E发生水解反应生成高聚物W为
,D与E发生水解反应生成高聚物W为![]() 。
。
(1)由上述分析可知,B的结构简式是CH2=CHCHO,故答案为:CH2=CHCHO;
(2)E为![]() ,所含官能团的结构简式为:-COOH,故答案为:-COOH;
,所含官能团的结构简式为:-COOH,故答案为:-COOH;
(3)根据信息可知B与水,在过氧化物生成C,反应中碳碳双键转化为碳碳单键,即B→C反应类型为加成反应,故答案为:加成反应;
(4)D+E→W的反应方程式为:![]() ,C与银氨溶液的反应方程为HOCH2CH2CHO+2Ag(NH3)2OH
,C与银氨溶液的反应方程为HOCH2CH2CHO+2Ag(NH3)2OH![]() HOCH2CH2COONH4+2Ag↓+3NH3↑+3H2O,故答案为:
HOCH2CH2COONH4+2Ag↓+3NH3↑+3H2O,故答案为:![]() ;HOCH2CH2CHO+2Ag(NH3)2OH
;HOCH2CH2CHO+2Ag(NH3)2OH![]() HOCH2CH2COONH4+2Ag↓+3NH3↑+3H2O;
HOCH2CH2COONH4+2Ag↓+3NH3↑+3H2O;
(5)满足以下条件的一个E(![]() )的同分异构体:①可发生银镜反应,说明有醛基,②可与NaHCO3溶液生成CO2,说明含有羧基,③能与FeCl3溶液反应显紫色,说明含有酚羟基,含有三个取代基为-OH、-CHO、-COOH,而-OH、-CHO与有邻、间、对三种位置,对应的-COOH分别有4种、4种、2种位置,所以共有10种同分异构体,故答案为:10。
)的同分异构体:①可发生银镜反应,说明有醛基,②可与NaHCO3溶液生成CO2,说明含有羧基,③能与FeCl3溶液反应显紫色,说明含有酚羟基,含有三个取代基为-OH、-CHO、-COOH,而-OH、-CHO与有邻、间、对三种位置,对应的-COOH分别有4种、4种、2种位置,所以共有10种同分异构体,故答案为:10。


科目:高中化学 来源: 题型:
【题目】2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛形(下图所示),故称为牛式二烯炔醇。下列有关说法正确的是( )

A.牛式二烯炔醇含有4种官能团
B.牛式二烯炔醇不能使酸性KMnO4溶液褪色
C.1 mol牛式二烯炔醇最多可跟4mol Br2发生加成反应
D.该有机物的化学式为C29H44O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热法炼铬废渣主要成分为Al2O3和Cr2O3,还含有MgO、FeO、Fe2O3等杂质,以下是以炼铬废渣为原料回收Al2O3和Cr2O3的流程图:

已知:
①“焙烧”涉及的主要反应:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
Cr2O3+Na2CO3+O2![]() Na2CrO4+CO2↑(未配平);
Na2CrO4+CO2↑(未配平);
②滤液2中涉及的反应:8CrO42--+3S2O32-+34H+===6SO42-+8Cr3++17H2O
③Ksp[Cr(OH)3]=8×10-32
根据题意回答下列问题:
(1)请完成下列化学方程式的配平:
Cr2O3+ Na2CO3+ O2 ![]() Na2CrO4+ CO2↑;
Na2CrO4+ CO2↑;
(2)炼铬废渣在焙烧前需球磨粉碎,其目的是 。
(3)滤渣1的主要成分是 。
(4)流程中可以循环利用的物质是 。
(5)写出步骤Ⅲ“碳分”的离子反应方程式: 。
(6)滤液2还原后的溶液中为使Cr3+沉淀完全,溶液pH应小于 。(已知:lg5=0.7;当溶液中离子浓度不大于1×10-5mol/L时,可以认为不含该离子)
(7)滤液2经多步操作还可以获得K2Cr2O7晶体,其操作依次是:加入稀硫酸酸化,加入KCl固体、蒸发浓缩、操作a、过滤、操作b、干燥。
①加硫酸酸化的目的是 。
②操作a、操作b分别是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能.已知部分化学键的键能如下:
化学键 | N—H | N—N | O=O | N≡N | O—H |
键能(kJ·mol-1) | 386 | 167 | 498 | 946 | 460 |
(1)发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态)。1 mol肼完全燃烧时放出的热量为________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液。肼-空气燃料电池放电时,正极的电极反应式是______________________________________。
(3)已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60的结构含有________个N—N键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | 反应 温度/℃ | c(H2O2)/ mol·L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究________________________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________(填序号)作对比。
(3)将实验1和实验2作对比,t1________t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-===2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1 mol·L-1 KI溶液 ②0.1 mol·L-1 FeCl3溶液
③0.1 mol·L-1 FeCl2溶液 ④0.1 mol·L-1 盐酸
⑤0.1 mol·L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘
(4)另取一份,加试剂________(填序号),现象________________________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100 mL密闭容器中投入0.01 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
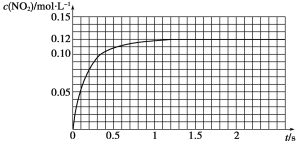
(1)反应容器中最后剩余的物质有________________,其中N2O4的物质的量为________mol。
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,从开始到平衡建立这段时间的平均反应速率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
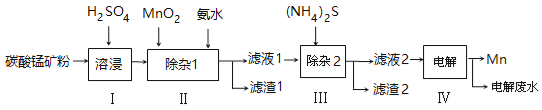
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行相关实验。下列结论正确的是
A.向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+c(CO32-)
B.向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-)
C.向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13
D.将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式 。
(2)298 K时,在2L的密闭容器中,发生可逆反应:2NO2(g)![]() N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。

①298K时,该反应的平衡常数为________。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。

a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,
则此时V(正) V(逆)(填“>”、“<”或“=”)。
 (3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①水的电离程度最大的是 ;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数
K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
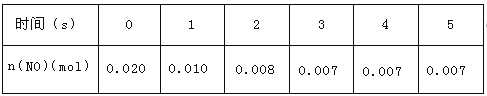
(1)下图表示NO2的变化曲线是_____。用O2表示从0-2s内该反应的平均速率v=____。
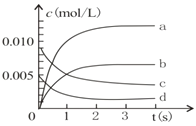
(2)能说明该反应己达到平衡状态的是_____(填字母序号,下同)。
a.v(NO2)=2v(O2)
b.容器内气体总物质的量保持不变
c.V逆(NO)=2v正(O2 )
d.容器内气体的密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是_____。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com