
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )| A. | 3.6g | B. | 4g | C. | 4.4g | D. | 4.8g |
分析 从图中可以看出,Mg(OH)2的质量为0.58 g,即0.01 mol,根据反应:MgCl2+2NaOH═2NaCl+Mg(OH)2↓,根据方程式求出氢氧化钠的物质的量;
由生成沉淀的质量关系图可知,滴加的前10mL稀盐酸,没有影响沉淀的量,说明滴加的稀盐酸在与混合物中剩余的氢氧化钠发生反应;
继续滴加稀盐酸时,沉淀量增加,此时稀盐酸与NaAlO2发生反应产生Al(OH)3沉淀;
综合以上分析,混合物中的氢氧化钠溶于水后与氯化镁、氯化铝发生反应后还有剩余,剩余的氢氧化钠与稀盐酸发生反应;固体物中的氯化铝与氢氧化钠反应生成NaAlO2,根据NaAlO2因此求出反应消耗的NaOH,然后求出NaOH总的物质的量和质量.
解答 解:从图中可以看出,Mg(OH)2的质量为0.58 g,即0.01 mol,根据反应:MgCl2+2NaOH═2NaCl+Mg(OH)2↓,
n1(NaOH)=2n[Mg(OH)2]=0.02 mol.
开始至加入10 mL盐酸,发生反应:NaOH+HCl═NaCl+H2O,
n2(NaOH)=n(HCl)=1mol•L-1×10×10-3L=0.01 mol.
盐酸的加入量从10~30 mL 发生反应:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
n(NaAlO2)=n(HCl)=1mol•L-1×(30-10)×10-3L=0.02 mol.
根据反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
n3(NaOH)=4n(NaAlO2)=0.08 mol,
m(NaOH)=(0.02 mol+0.01mol+0.08 mol)×40 g•mol-1=4.4 g.
故选C.
点评 根据滴加稀盐酸与产生沉淀的关系图,分析各阶段所发生的反应,利用各阶段反应的化学方程式进行相关物质质量的计算;本题所涉及的反应比较复杂,在分析时逐个反应梳理清楚是解决本问题的关键.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电子式: | |
| B. | 氮原子的L层电子轨道表示式: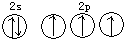 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:126C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 吸收塔中的硫元素可能以单质形式存在 | |
| B. | 中和池中只发生生成沉淀的复分解反应 | |
| C. | 在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 | |
| D. | 由题意分析得到,沉淀可能是Cr(OH)6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气在生产、生活中具有广泛的应用.
天然气在生产、生活中具有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 原子的最外层电子数都是7个 | |
| C. | 它们的单质的颜色随核电荷数的增加而加深 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | B. | 它不可能与NaOH溶液反应 | ||
| C. | 它既含离子键又含共价键 | D. | 它受热时不会分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com