
 xC(g)+D(g)�У���֪����Ӧ��ʼ���������ֻ��A��B����ʼŨ��AΪ5 mol��L-1��BΪ3 mol��L-1��ǰ2 min C��ƽ����Ӧ����Ϊ0��5 mol��L-1��min-1��2 min���D��Ũ��Ϊ0��5 mol��L-1�����跴Ӧǰ����Һ������䣩����ڴ˷�Ӧ������˵������ȷ����(����)
xC(g)+D(g)�У���֪����Ӧ��ʼ���������ֻ��A��B����ʼŨ��AΪ5 mol��L-1��BΪ3 mol��L-1��ǰ2 min C��ƽ����Ӧ����Ϊ0��5 mol��L-1��min-1��2 min���D��Ũ��Ϊ0��5 mol��L-1�����跴Ӧǰ����Һ������䣩����ڴ˷�Ӧ������˵������ȷ����(����) xC��g��+D��g��
xC��g��+D��g�� 

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| ���� | ��H��kJ?mol-1�� | ���� | ��H��kJ?mol-1�� |
| C��s�� | -393.5 | C2H6��g�� | -1559.8 |
| H2��g�� | -285.8 | C3H8��g�� | -2219.9 |
| C2H4��g�� | -1411.0 | C12H26��l�� | -8162.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| t /min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������̼���ƹ��� | B������18 mol/L��ŨH2SO4 |
| C��������������ͭ��Һ | D�������������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 3c(g)�������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ1��ʾ��������t0��t1��c(B)δ������ͼ2Ϊ��Ӧ��ϵ�з�Ӧ������ʱ��仯���������t2��t3��t4���ı�һ�ֲ�ͬ��������
3c(g)�������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ1��ʾ��������t0��t1��c(B)δ������ͼ2Ϊ��Ӧ��ϵ�з�Ӧ������ʱ��仯���������t2��t3��t4���ı�һ�ֲ�ͬ��������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)������
xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

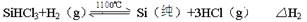
| ���� | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| �е� | 12��1 | 73��5 | 57��0 | 129��4 | 180�������� | 31��2 |
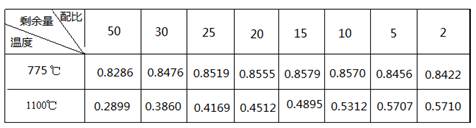
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
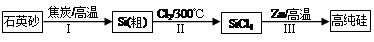
 Si(S)+2ZnCl2(l) ��H1��0
Si(S)+2ZnCl2(l) ��H1��0 Si(S)+2ZnCl2(g) ��H2��0
Si(S)+2ZnCl2(g) ��H2��0 Si(S)+2ZnCl2(g) ��H3��0
Si(S)+2ZnCl2(g) ��H3��0�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com