
| A. | 该溶液中含有1mol Na2SO4 | |
| B. | 将1mol Na2SO4溶于1L中可得到该溶液 | |
| C. | 溶液中Na+的物质的量浓度为2mol•L-1 | |
| D. | 1L该溶液中含有2mol Na+和2mol SO42- |
分析 A、溶质的物质的量与溶液体积有关.
B、将1mol Na2SO4溶于1L水中,所得溶液的体积大于1L;
C、Na2SO4由2个钠离子和1个硫酸根构成;
D、求出硫酸钠的物质的量,然后根据Na2SO4由2个钠离子和1个硫酸根构成来分析.
解答 解:A、根据溶质的物质的量n=CV可知,溶质的物质的量与溶液的体积有关,而溶液体积未告诉,无法计算溶质的物质的量,故A错误;
B、将1mol Na2SO4溶于1L水中,所得溶液的体积大于1L,则所得溶液的浓度小于1mol/L,得不到该溶液,故B错误;
C、Na2SO4由2个钠离子和1个硫酸根构成,故1mol•L-1 Na2SO4溶液中钠离子的浓度为2mol/L,故C正确;
D、1L溶液中硫酸钠的物质的量n=CV=1mol/L×1L=1mol,而Na2SO4由2个钠离子和1个硫酸根构成,故1mol硫酸钠中含2mol钠离子和1mol硫酸根,故D错误.
故选C.
点评 本题考查学生对物质的量浓度的理解,难度不大,注意基础知识的理解掌握.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
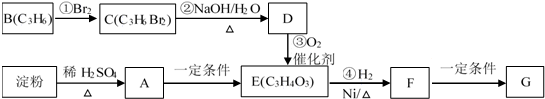
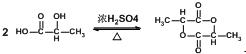 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 碘熔化破坏了共价键 | |
| B. | 从石墨剥离得石墨烯(如右图)需克服范德华力 | |
| C. | 含极性键的共价化合物一定是电解质 | |
| D. | HF的分子间作用力大于HCl,故氟化氢比氯化氢更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯不与溴水发生加成反应 | B. | 苯不能被酸性KMnO4溶液氧化 | ||
| C. | 1mol苯能与3molH2发生加成反应 | D. | 苯能够燃烧产生浓烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol/(L•min ) | B. | 0.1mol/(L•min ) | C. | 0.125mol/(L•min ) | D. | 0.25mol/(L•min ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: | |
| B. | 1mol Na2O2中阴、阳离子总数为4NA | |
| C. | NaOH是离子化合物,含有离子键和共价键 | |
| D. | 28g C2H4中含有4NA对共用电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
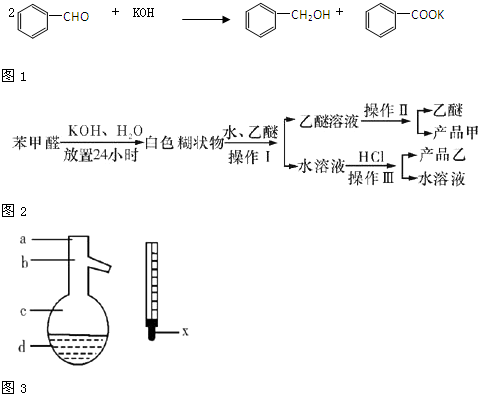
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
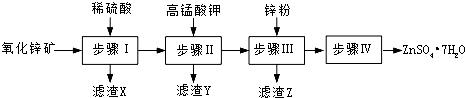

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肥皂中含有甘油(氯化钠、盐析) | B. | 乙醇中含有水(氧化钙、蒸馏) | ||
| C. | 溴苯含有溴(氢氧化钠溶液、分液) | D. | 苯中含有苯酚(浓溴水,过滤) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com