
【题目】下列各项所述的数字是6的是( )
A. 在NaCl晶体中,与一个Na+最近的且距离相等的Na+ 的个数
B. 在晶体硅中,围成最小环的原子数
C. 在二氧化硅晶体中,围成最小环的原子数
D. 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数
【答案】B
【解析】本题考查的是晶体的结构分析,重点是对结构图像的观察与理解,掌握常见晶胞的结构是解题的关键。
A.氯化钠晶体属于面心立方结构,晶胞如图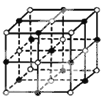 ,由结构可知,氯化钠晶体中氯离子位于顶点和面心,钠离子位于体心和棱心,所以观察体心的钠离子,与其距离最近的钠离子在12个棱的棱心,故在氯化钠晶体中每个钠离子周围紧邻12个钠离子,故错误;B.晶体硅中,由共价键形成的最小环上有6个硅原子,每个硅原子形成四个共价键,从而形成空间网状结构,故正确;C.由二氧化硅晶体结构
,由结构可知,氯化钠晶体中氯离子位于顶点和面心,钠离子位于体心和棱心,所以观察体心的钠离子,与其距离最近的钠离子在12个棱的棱心,故在氯化钠晶体中每个钠离子周围紧邻12个钠离子,故错误;B.晶体硅中,由共价键形成的最小环上有6个硅原子,每个硅原子形成四个共价键,从而形成空间网状结构,故正确;C.由二氧化硅晶体结构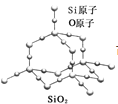 分析,晶体中最小环上含有6个硅原子和6个氧原子,共12个原子,故错误;D. 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数是8,故错误,故选B。
分析,晶体中最小环上含有6个硅原子和6个氧原子,共12个原子,故错误;D. 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数是8,故错误,故选B。


科目:高中化学 来源: 题型:
【题目】I.某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
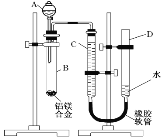
(1)实验前,先将铝镁合金在稀酸中浸泡片刻。检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;②待B中不再有气体产生并恢复至室温后,记录C的液面位置;③检查气密性;④由A向B中滴加足量试剂;⑤将B中剩余固体过滤,洗涤,干燥,称重,上述操作的顺序是_______,(填序号)②中记录C的液面位置前,还应______。
(2)A中装的试剂为________。
(3)若实验用铝镁合金的质量为m1g,测得氢气体积为amL(已换算为标准状况),B中剩余固体的质量为m2g,则铝的相对原子质量为_______。
II.某化学研究小组的同学,为了探究催化剂对化学反应速率的影响,做了以下实验:将0.20mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示
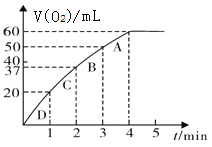
(4)A、B、C、D各点反应速率快慢的顺序为_______。
(5)计算H2O2的初始物质的量浓度_____ (请保留两位有效数字) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Science杂志在2017 年报道了世界上首个成功合成的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(白色固体),这是全氮含能材料里程碑式的突破。该盐结构如图,下列分析不合理的是
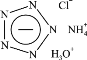
A. 五氮阴离子的化学式为N5—
B. 该盐中阴阳离子数目之比为 ![]()
C. 该盐在碱中比在酸中稳定
D. 该盐存在离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是
A. Zn为电池的负极
B. 正极反应式为![]() +10H++6e-===Fe2O3+5H2O
+10H++6e-===Fe2O3+5H2O
C. 该电池放电过程中电解质溶液碱性增大
D. 电池工作时OH-向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①Na2S、②金刚石、③NH4Cl、④Na2SO4、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是____________,熔化时需要破坏共价键的是____________,熔点最高的是____________,熔点最低的是_____________(填序号)。
(2)属于离子化合物的是_______________________,只有离子键的物质是____________,以分子间作用力结合的物质是____________________(均填序号),③的电子式____________________。
(3)用电子式表示①的形成过程是______________________,用电子式表示⑥的形成过程是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请回答下列问题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有______种。
(2)画出第四周期的第ⅠB族元素基态原子电子排布式:____________________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是_______________(填化学式)。
(5)第ⅢA族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。硼酸的结构式可表示为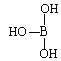 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:_______________________________。
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:_______________________________。
(6)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体分子_________,三角锥形分子 _________ 。
(7)钛被称为未来金属,已知某钛的化合物TiCl3·6H2O(相对分子质量为262.5)配位数为6,取该晶体26.25克配成溶液,加入足量硝酸银溶液,过滤,洗涤,烘干,称重,沉淀为28.70克,则该晶体的化学式可表示为______________________________。
(8)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_____________;若两种 晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为____________。
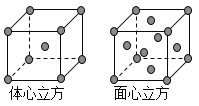
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
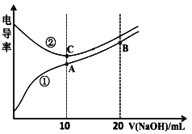
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+) > c(OH-) > c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
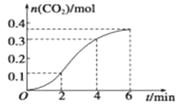
A. 反应在2~4 min内平均反应速率最大
B. 反应开始4 min内温度比浓度对反应速率的影响大
C. 4 min后,反应速率减小的主要原因是c(H+)减小
D. 反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.1 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com