
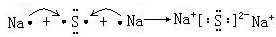 ,故答案为:
,故答案为: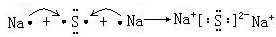 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、5.6 g 铁在足量氯气中燃烧,电子转移0.2 NA |
| B、标准状况下,2.24 L水中含有水分子0.1 NA |
| C、1.12 L氯气中含有氯原子0.1 NA |
| D、32克O2所含的氧原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子量外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄钾铁矾中铁元素显+3价 |
| B、黄钾铁矾属于碱 |
| C、黄钾铁矾溶于硫酸后,滴加KSCN溶液,溶液变红 |
| D、黄钾铁矾晶体在酒精灯火焰上灼烧,透过蓝色的钴玻璃可观察到紫色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
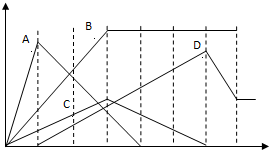 如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表.
如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表. | 序号 | 实验操作 | 对应编号 |
| ① | 向澄清石灰水中通入CO2至过量 | |
| ② | 向AlCl3溶液中逐滴加入氨水至过量 | |
| ③ | 向含有盐酸的MgCl2、AlCl3溶液中通入NaOH溶液至过量 | |
| ④ | 向NaAlO2溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
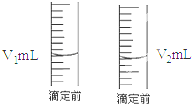 现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、10 min内,v(Cl2)=0.04 mol/(L?min) |
| B、当容器中Cl2为1.2 mol时,反应达到平衡 |
| C、升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的转化率变大 |
| D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com