
 Ⅰ.t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:
Ⅰ.t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:分析 Ⅰ.(1)根据平均反应速率v=$\frac{△c}{△t}$计算出反应速率;根据方程式可计算出平衡时各物质的物质的量,根据SO2的体积分数=$\frac{二氧化硫的物质的量}{混合气体总体物质的量}$×100%计算体积分数;
(2)化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
(3)反应物能量高于生成物能量,反应放热,反之则反应吸热,据此判断;
Ⅱ.镁、铝在氢氧化钠溶液中,铝与氢氧化钠反应生成氢气和偏铝酸钠,铝是还原剂,作负极,发生氧化反应,据此答题;
解答 解:Ⅰ.(1)还剩余0.8 mo1氧气可知:反应消耗0.4mol SO2和0.2mol O2,生成0.4mol SO3,平衡时SO2的物质的量为2mol-0.4mol=1.6mol,
三氧化硫的反应速率为v(SO3)=$\frac{\frac{0.4mol}{2L}}{2min}$=0.1mol•L-1•min-1,
SO2的体积分数=$\frac{1.6mol}{1.6mol+0.8mo1+0.4mol}$×100%=57.1%,
故答案为:0.1mol•L-1•min-1;57.1%;
(2)A.容器内压强不再发生变化,该反应两边气体体积不相等,反应过程中压强是变量,压强不变,该反应达到了平衡状态,故A正确;
B.SO2的体积分数不再发生变化,表明正逆反应速率相等,达到了平衡状态,故B正确;
C.容器内气体原子总数不再发生变化,根据原子守恒,原子总数始终不变,所以原子总数不能作为判断平衡状态的依据,故C错误;
D.相同时间内消耗2nmolSO2的同时消耗nmolO2,都是指的是正反应方向,因此不能作为判断平衡状态的依据,故D错误;
E.相同时间内消耗2nmolSO2的同时生成nmolO2,相同时间内消耗2n mol SO2等效于消耗n mol O2,同时生成n mol O2,正反应速率等于逆反应速率,故E正确;
故答案:ABE;
(3)根据图可知反应物能量高于生成物能量,所以该反应为放热反应,
故答案为:放热;
Ⅱ.镁、铝在氢氧化钠溶液中,铝与氢氧化钠反应生成氢气和偏铝酸钠,铝是还原剂,作负极,发生氧化反应,负极电极反应为Al+4OH--3e-=AlO2-+2H2O,总反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查学生化学平衡的判断和化学平衡的移动以及反应热、电化学知识,题目难度中等,要求学生掌握判断平衡状态的方法,试题培养了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b时:c(OH-)=c(H+)+c(HS-) | |
| B. | a=2b时:C(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) | |
| C. | a=2.5b时:C(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) | |
| D. | 若4c(Na+)=5c(S2-)+5c(HS-)+5c(H2S),a=3b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液 | B. | 盐酸 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硝酸 | CaCO3 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
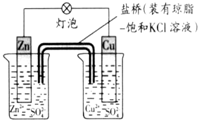
| A. | 正极反应为:Zn-2e-=Zn2+ | B. | Cu为负极,发生还原反应 | ||
| C. | 盐桥中的K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2在一定条件下可以支持燃烧 | B. | 该反应是一个放热反应 | ||
| C. | 该实验的反应中有O2生成 | D. | Na2O2可作为呼吸面具中氧气来源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com